题目内容
3.近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.根据下列示意图回答有关问题: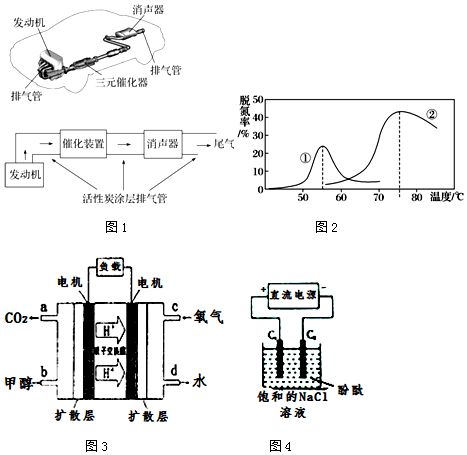
(1)汽车发动机工作时会引发
(Ⅰ)N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其能量变化示意图1:
[(N2 ( )$\stackrel{946kJ•mol-1}{→}$2Ng( )O2g( )$\stackrel{498kJ•mol-1}{→}$2Og( )]$\stackrel{-akg•mol-1}{→}$2NO(g)
则NO中氮氧键的键能为682kJ/molkJ•mol-1.
(2)空燃比过小易产生CO,有人提出可以设计反应2CO(g)═2C(s)+O2(g)来消除CO的污染.判断该设想是否可行,并说出理由:不合理.该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0,则△G>0.
(3)在汽车上安装三元催化转化器可实现反应:(Ⅱ)2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0.若该反应在恒压的密闭容器中进行,则下列有关说法正确的是C
A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,使平衡常数增大
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率减小
C.在恒温条件下,混合气体的密度不变时,反应达到化学平衡状态
D.平衡时,其他条件不变,增大NO的浓度,反应物的转化率都增大
(4)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图2所示.以下说法正确的是D.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.两种催化剂分别适宜于55℃和75℃左右脱氮
(5)甲醇空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图3,该燃料电池的电池反应式为2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)
①用上述电池做电源,用图4装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,电解初始在电极C2(填“C1”或“C2”)的周围先出现红色.
②当有8g甲醇完全反应,在C<sub>2</sub>上可收集到标准状况下气体的体积为16.8L.
分析 (1)△H=反应物的键能总和-生成物的键能总和;
(2)根据△G=△H-T△H<0来判断反应的自发性;
(3)A.催化剂不能改变化学平衡;
B.升高温度,正逆反应速率增大;
C.该反应为气体参与生成气体的反应,反应前后气体的质量不变,但体积数减小,结合ρ=$\frac{m}{V}$分析;
D.平衡时,其他条件不变,增大NO的浓度,反应物NO的转化率减小;
(4)A.催化剂只影响反应速率,不会改变转化率;
B.增大压强平衡向逆反应方向移动;
C.最高点为催化剂活性最高的温度;
D.根据图象判断,脱氨率最高的点对应的温度应是最适宜温度;
(5)①电解饱和食盐水时,反应物为氯化钠和水,生成物为氢氧化钠、氢气和氯气,据此写出反应的离子方程式;电解过程中,阳极氯离子失去生成氯气,阴极水电离的氢离子得到电子生成氢气,同时产生氢氧根离子;
②依据电极反应电子守恒计算,原电池负极电极反应CH3OH+H2O-6e-═CO2+6H+,和电解池阴极电极反应2H++2e-=H2↑存在电子守恒.
解答 解::(1)设NO中氮氧键的键能为x,△H=反应物的键能总和-生成物的键能总和=(946+498)kJ•mol-1-2×x=180kJ/mol,解得x=632 kJ/mol,
故答案为:632;
(2)2CO(g)=2C(s)+O2(g)(△H>0、△S<0)是一个焓增、熵减的反应,任何情况下不能自发进行,所以无法消除CO的污染,
故答案为:不合理,该反应焓增、熵减,任何条件下都不能自发进行或该反应△H>0,△S<0,则△G>0;
(3)A.其他条件不变,增大催化剂与反应物的接触面积,能提高反应速率,平衡常数只与温度有关,温度不变,平衡常数不变,故A错误;
B.平衡时,其他条件不变,升高温度,逆反应速率增大,正反应速率也增大,故B错误;
C.该反应为气体参与生成气体的反应,反应前后气体的质量不变,但体积数减小,密度$ρ=\frac{m}{V}$,混合气体的密度不变时,反应达到化学平衡状态,故C正确;
D.平衡时,其他条件不变,增大NO的浓度,反应物CO的转化率增大,反应物NO的转化率减小,故D错误;
故答案为:C;
(4)A.催化剂不会影响转化率,只影响反应速率,所以第②种催化剂和第①种催化剂对转化率没有影响,故A错误;
B.反应为体积增大的反应,增大压强平衡向逆反应方向移动,脱氮率减小,故B错误.
C.图象研究的是不同催化剂在不同的温度下的活性比较,最高点为催化剂活性最大的状态,与平衡转化率无关,故C错误;
D.两种催化剂分别在55℃和75℃左右催化效率最高,说明此时催化剂的活性最大,故D正确;
故答案为:D;
(5)①电解饱和食盐水生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,电解反应中,阴极水电离的氢离子得到电子生成氢气,同时产生了氢氧根离子,所以在阴极C2 (连接电源负极的电极)先变红,
故答案为:2Cl-+2H2$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;C2;
②原电池负极电极反应CH3OH+H2O-6e-═CO2+6H+,和电解池阴极电极反应2H++2e-=H2↑存在电子守恒,CH3OH~3H2↑~6e-,当有8g甲醇完全反应物质的量=$\frac{8g}{32g/mol}$=0.25mol,在C2上可收集到标准状况下气体的体积=0.25mol×3×22.4L/mol=16.8L,
故答案为:16.8L.
点评 本题考查了键能计算、化学平衡影响因素、电解池工作原理及其应用等知识,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意原电池和电解池工作原理中的电子守恒应用和化学平衡影响因素高频考点.题目难度中等,是中档题.

 阅读快车系列答案
阅读快车系列答案| A. | 砒霜的主要成分是三硫化二砷 | |
| B. | 水分子间的氢键是一种特殊的化学键 | |
| C. | 过量服用阿司匹林引起酸中毒后,可用静脉注射NaHCO3溶液的方法解毒 | |
| D. | 铜单质制成的“纳米铜”在空气中能燃烧,说明“纳米铜”的金属性比铜片强 |
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液.
②加入V1mL c1mol•L-1 AgNO3溶液(过量),充分摇匀.
③用c2mol•L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL.
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-═AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是( )
| A. | 滴定终点时,溶液变为红色 | |
| B. | 该滴定法需在碱性条件下进行 | |
| C. | AgBr(s)+SCN-?AgSCN(s)+Br-(aq)的平衡常数K=0.77 | |
| D. | 该水样中溴离子浓度为:c(Br-)=$\frac{({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{25.00}$mol/L |
| A. | 不能和氢氧化钠溶液发生反应 | |
| B. | 分子中N≡C键的键长大于C-C键的键长 | |
| C. | 该分子与H2O2分子的空间构型类似 | |
| D. | 分子中原子的最外层均满足8电子结构 |
| A. | 乙醇在加热的条件下,可以使黑色的氧化铜变红,生成具有特殊气味的乙醛 | |
| B. | 葡萄糖在一定条件下可以水解生成乙醇和二氧化碳 | |
| C. | 油脂和乙酸乙酯都属于酯类物质,碱性下水解都称之为皂化反应 | |
| D. | 豆浆中富含大豆蛋白,煮沸后蛋白质即水解生成氨基酸 |
( )
| A. | 反应中MnO2是还原剂 | |
| B. | 电池工作时,海水起导电作用,其中NaCl浓度保持不变 | |
| C. | Ag为负极,电极反应为Ag-e-+Cl-=AgCl | |
| D. | 每生成1 mol Na2Mn5Ol0转移1mol电子 |

要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题.
原料价格表
| 物质 | 价格/(元•吨-1) |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤④中加入的试剂Y是碳酸钠;
(3)在步骤⑤中发生反应的化学方程式是H2O+MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
| A. | 易导电 | B. | 易导热 | C. | 有延展性 | D. | 易锈蚀 |
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 饱和氯水中:NH4+、SO32-、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br- |