题目内容
18.下列离子方程式正确的是( )| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| B. | 明矾溶液与等物质的量的氢氧化钡溶液混合:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ |
分析 A.过氧化钠具有强氧化性,能够将亚硫酸根离子氧化硫酸根离子;
B.氢氧化钡不足,反应生成硫酸钡、氢氧化铝沉淀;
C.反应生成氢氧化镁、碳酸钙沉淀;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.NaHSO3溶液中投入过氧化钠粉末,二者发生氧化还原反应,正确的离子方程式为:HSO3-+Na2O2═SO42-+OH-+2Na+,故A错误;
B.明矾溶液与等物质的量的氢氧化钡溶液混合,氢氧化钡不足,反应生成硫酸钡、氢氧化铝沉淀,反应的离子方程式为:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓,故B正确;
C.氢氧化钙溶液与碳酸氢镁溶液反应的离子反应为Mg2++2Ca2++4OH-+2HCO3-═2CaCO3↓+2H2O+Mg(OH)2↓,故C错误;
D.将氯化亚铁溶液和稀硝酸混合,二者发生氧化还原反应,正确的离子方程式为:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
相关题目
8.某有机物是甲酸和乙醇反应后生成物的同分异构体,此有机物是( )
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙二酸 | D. | 丁酸 |
9.实验室用二氧化锰和浓盐酸制取氯气时,最佳的除杂试剂和方法是( )
| A. | 水、浓H2SO4、洗气 | B. | 饱和NaHCO3溶液、浓H2SO4、洗气 | ||
| C. | 饱和NaCl溶液、浓H2SO4、洗气 | D. | NaOH溶液、浓H2SO4、洗气 |
6.下列符合化学实验“绿色化”的有( )
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②汞不慎洒落地面时,要先用硫磺粉覆盖,使其化合成硫化汞后再妥善处理
③将实验室的废酸与废碱中和后再排放.
①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
②汞不慎洒落地面时,要先用硫磺粉覆盖,使其化合成硫化汞后再妥善处理
③将实验室的废酸与废碱中和后再排放.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
13.如果a g某气体中含有的分子数为b个,则c g该气体在标准状况下的体积(单位:升)是(NA表示阿伏加德罗常数)( )
| A. | 22.4ac/bNA | B. | 22.4ab/cNA | C. | 22.4bc/aNA | D. | 22.4b/acNA |
7.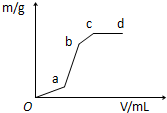 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
 向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )
向用盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液,产生的沉淀质量m与加入的体积V之间的关系,关于图曲线的推测正确的是( )| A. | ab段产生的沉淀为硫酸钡 | |
| B. | ab产生段的沉淀为氢氧化镁 | |
| C. | bc段产生的沉淀为氢氧化镁 | |
| D. | bc段产生的沉淀为硫酸钡和氢氧化镁 |
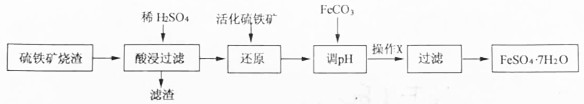
6.某研究小组利用硫铁矿烧渣(主要成分是Fe2O3,还有少量的FeO、Fe3O4、Al2O3、SiO2等杂质)制备FeSO4•7H2O晶体的流程如图:
已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
请回答下列问题:(1)酸浸时主要反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,滤渣的主要成分是SiO2
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.

已知:①活化硫铁矿还原Fe3+的反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
②几种金属阳离子的氢氧化物沉淀时的pH如表所示
| Fe3+ | Al3+ | Fe2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 |
(2)检验“还原“步骤中Fe3+是否被完全还原,应选择C(填字母编号)
A、KMnO4溶液 B、NaOH溶液 C、KSCN溶液
(3)加FeCO3调节溶液pH至5.2~6.5(填pH范围)其目的是除去铝离子,防止生成氢氧化亚铁沉淀
(4)操作X的名称是搅拌、静置.