题目内容
10.若向20mL 1mol/L AlCl3溶液中加入30mL KOH溶液得沉淀0.78g,则KOH溶液的物质的量浓度为1mol/L或5mol/L.分析 根据20mL 1mol/L AlCl3溶液与KOH溶液的反应计算分析,20mL1mol/L20mL 1mol/L AlCl3全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,二是使Al(OH)3部分溶解,以此计算.
解答 解:20mL1mol/L20mL 1mol/L AlCl3完全转化为沉淀的质量为:0.02L×2mol/L×78g/mol=3.12g,
根据Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+H2O,可知KOH存在两种情况,一是不足,
二是使Al(OH)3部分溶解,
设KOH的浓度为c,当KOH不足时,
Al3++3OH-=Al(OH)3↓
3mol 78g
0.03L×c 0.78g
c=$\frac{0.78g×3mol}{78g×0.03L}$=1mol/L,
当KOH使Al(OH)3部分溶解时,设KOH的物质的量为x,根据反应:
Al3++3OH-=Al(OH)3↓
1mol 3mol 78g
0.04mol 0.12mol 3.12g
Al(OH)3+OH-=AlO2-+H2O
78g 1mol
(3.12-0.78)g (x-0.12mol)
x=0.15mol,
则KOH的物质的量浓度为:c=$\frac{0.15mol}{0.03L}$=5mol/L,
由上述分析计算可知,KOH溶液的物质的量浓度为1mol/L或5mol/L,
故答案为:1mol/L;5mol/L.
点评 本题考查物质的量浓度的计算,题目难度中等,注意判断氯化铝反应的程度,为解答本题的关键,用讨论法解答,试题培养了学生的化学计算能力.

| A. | 该溶液的pH可能为2 | |
| B. | 若该溶液中的溶质只有一种,它可能是酸、碱或盐 | |
| C. | 向该溶液中加入铝片一定有氢气产生 | |
| D. | HSO3-、HS-、HPO42-等离子在该溶液中不能大量共存 |
| A. | 0.4mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.1mol•L-1 |
| A. | NaHSO3溶液中投入过氧化钠粉末:4HSO3-+2Na2O2═4SO32-+O2↑+4Na+ | |
| B. | 明矾溶液与等物质的量的氢氧化钡溶液混合:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ | |
| C. | 氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑ |
 被誉为“百年新药”的阿司匹林的有效成分是乙酰水杨酸,其结构简式如图所示,下列关于乙酰水杨酸的说法中,不正确的是( )
被誉为“百年新药”的阿司匹林的有效成分是乙酰水杨酸,其结构简式如图所示,下列关于乙酰水杨酸的说法中,不正确的是( )| A. | 可用于治疗胃酸过多 | B. | 分子式为C9H8O4 | ||
| C. | 能与乙醇发生酯化反应 | D. | 能与H2发生加成反应 |
| A. | NH3 | B. | CH3COOH | C. | HNO3 | D. | HClO |
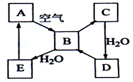 如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A(淡黄色)及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.