题目内容
15.CO气体中可能混有 SO2和CO2,若测得此混合气体中氧元素质量分数为60%,则该混合气体中一定混有的气体是( )| A. | SO2 | B. | CO2 | C. | CO2或SO2 | D. | 不能确定 |
分析 CO中氧元素质量分数为$\frac{16}{28}$×100%=57.1%,SO2中O元素的质量分数为$\frac{32}{64}$×100%=50%,CO2中O元素的质量分数为$\frac{32}{44}$×100%=72.7%,结合此混合气体中氧元素质量分数为60%来解答.
解答 解:SO2中O元素的质量分数为$\frac{32}{64}$×100%=50%,CO2中O元素的质量分数为$\frac{32}{44}$×100%=72.7%,
CO中氧元素质量分数为$\frac{16}{28}$×100%=57.1%,含CO的混合气体中氧元素质量分数为60%,CO的O元素质量分数小于60%,则另一种气体中O元素质量分数大于60%,
可知CO中一定含CO2,可能含SO2,
故选B.
点评 本题考查元素质量分数的计算,为高频考点,把握元素质量分数的计算、平均值法的应用为解答的关键,侧重分析与计算能力的考查,注意结合平均质量分数判断混合气体的组成,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
8.浓度均为0.1mol•L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )
| A. | BaCl2 NaOH NaHCO3 | B. | NaHCO3 CaCl2 HCl | ||
| C. | AlCl3 MgCl2 NaOH | D. | Ba(OH)2 CaCl2 H2SO4 |
10.氯气和二氧化硫都可以做漂白剂,若两者混合使用,漂白效果会( )
| A. | 增强 | B. | 减弱 | C. | 不变 | D. | 难以确定 |
20.密闭容器中反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0达到平衡后,下列措施能使n(CH3OH)/n(CO2)增大的是( )
| A. | 升高温度 | B. | 保持容器的体积不变充入1molHe | ||
| C. | 将水蒸气从体系中分离出 | D. | 增大容器容积,减小压强 |
7.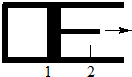 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
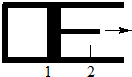 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率减小 | D. | C的体积分数降低 |
4.化学与生活、社会发展息息相关,下列有关说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | 安装燃煤“固硫”装置,可以降低酸雨发生率 | |
| C. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
5.化学已渗透到人类生活的各个方面,下列说法不正确的是( )
| A. | 交警检查司机是否酒后驾车的原理中体现了乙醇的氧化性 | |
| B. | 硅胶多孔,吸附水分能力强,常用作袋装食品、瓶装药品的干燥剂 | |
| C. | 铜的金属活动性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| D. | 以石油、煤和天然气为原料通过聚合反应可以获得用途广泛的高分子合成材料 |