题目内容
(1)配平下列离子方程式:
+
(2)称取12.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成500mL溶液.量取此溶液50mL置于锥形瓶中,再向锥形瓶中滴加0.10mol?L-1的酸性高锰酸钾溶液,至32mL时反应完全,此时溶液颜色由
5
5
C2| O | 2- 4 |
2
2
Mn| O | - 4 |
16
16
H+
|
10
10
CO2↑+2
2
Mn2+8
8
H2O(2)称取12.0g含H2C2O4?2H2O、KHC2O4和K2SO4的试样,加水溶解,配成500mL溶液.量取此溶液50mL置于锥形瓶中,再向锥形瓶中滴加0.10mol?L-1的酸性高锰酸钾溶液,至32mL时反应完全,此时溶液颜色由
无色
无色
变为紫红色
紫红色
;该50mol溶液中还原剂的物质的量为0.008
0.008
mol.分析:(1)化合价有变化的是碳元素和锰元素,根据化合价变化配平;
(2)原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色;再根据电子守恒求算氢离子物质的量.
(2)原溶液无色,KMnO4为紫红色,当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色;再根据电子守恒求算氢离子物质的量.
解答:解:(1)化合价C:+3→+4,改变量(4-3)×2=2,Mn:+7→+2,改变量(7-2)×1=5,根据化合价升降总数相等,所以在C2O42-前配5,MnO4-前配2,根据C和Mn原子守恒,分别在CO2和Mn2+前配10和2,根据电荷守恒,在H+前配16,最后根据离子方程式两边的H个数相等在水前面配8,经检验离子方程式两边的氧原子相等.
故答案为:5;2;16;10;2;8;
(2)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色,
由电子守恒得:n(还)×2=0.1mol?L-1×0.032L×5,n(还)=0.008mol,
故答案为:无色;紫红色;0.008.
故答案为:5;2;16;10;2;8;
(2)原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,溶液呈紫红色,
由电子守恒得:n(还)×2=0.1mol?L-1×0.032L×5,n(还)=0.008mol,
故答案为:无色;紫红色;0.008.
点评:本题考查了氧化还原反应的配平及中和滴定的物质的量浓度的计算,可以根据所学知识完成,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 +______,
+______,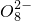 +H2O→Mn
+H2O→Mn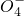 +S
+S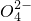 +H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.
+H+,该反应常用于检验Mn2+的存在.其特征现象是______,?若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol.