题目内容
20.鸟粪石(MgNH4PO4•6H2O)是农业上的一种缓释肥.由含镁原料液(主要成分为MgSO4、NaCl和极少量MnSO4)制取鸟粪石的流程如图:
(1)“除锰”时发生反应的离子方程式为Mn2++ClO-+2H2O=MnO(OH)2↓+Cl-+2H+.
(2)已知Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.1×10-11,若“一次沉镁”时得到的“沉淀1”是MgCO3•3H2O,则发生反应的离子方程式为Mg2++HCO3-+NH3•H2O+2H2O=MgCO3•3H2O↓+NH4+;若测得“沉淀1”中含较多的Mg(OH)2,其主要原因是加入的氨水过多,碱性太强.
(3)“合成”时,加入氨水的作用是参与反应并调节溶液pH值;“过滤2”中的滤液回收氨的方法是加入石灰乳加热将生成氨气蒸出,用水来吸收氨气.
分析 含镁原料液(主要成分为MgSO4、NaCl和极少量MnSO4)加NaClO溶液将二价锰离子氧化成MnO(OH)2,过滤从而除去锰,再加NH4HCO3和氨水一次沉镁,过滤,得到MgCO3•3H2O,再加NaH2PO4和氨水调节pH值为8.5-9.5,再次沉淀过滤得到MgNH4PO4•6H2O,滤液循环再利用,据此分析解答.
解答 解:(1)含镁原料液(主要成分为MgSO4、NaCl和极少量MnSO4)加NaClO溶液将二价锰离子氧化成MnO(OH)2,则“除锰”时发生反应的离子方程式为Mn2++ClO-+2H2O=MnO(OH)2↓+Cl-+2H+;故答案为:Mn2++ClO-+2H2O=MnO(OH)2↓+Cl-+2H+;
(2)“一次沉镁”时加NH4HCO3和氨水,过滤,得到MgCO3•3H2O,则镁离子与碳酸氢根离子以及一水合氨混合反应生成MgCO3•3H2O沉淀和铵根,则发生反应的离子方程式为Mg2++HCO3-+NH3•H2O+2H2O=MgCO3•3H2O↓+NH4+;因为Ksp(MgCO3)=6.8×10-6,Ksp[Mg(OH)2]=1.1×10-11,则Ksp[Mg(OH)2]更小,所以若测得“沉淀1”中含较多的Mg(OH)2,其主要原因是加入的氨水过多,碱性太强,故答案为:Mg2++HCO3-+NH3•H2O+2H2O=MgCO3•3H2O↓+NH4+;加入的氨水过多,碱性太强;
(3)因为合成时加NaH2PO4和氨水调节pH值为8.5-9.5,再次沉淀过滤得到MgNH4PO4•6H2O,则加入氨水的作用是参与反应并调节溶液pH值;“过滤2”中的滤液主要含铵根,则可以加入石灰乳加热将生成氨气蒸出,用水来吸收氨气,从而回收氨,故答案为:参与反应并调节溶液pH值;加入石灰乳加热将生成氨气蒸出,用水来吸收氨气.
点评 本题以工业流程图为依托,考查了反应条件的控制原因的分析、离子方程式的书写等,题目难度中等,解题关键是合理分析题中流程及准确把握物质的性质,试题培养了学生分析、理解能力及灵活应用所学知识的能力.

| A. | CuFeS2中硫的化合价为-1价 | |
| B. | Fe2O3为氧化产物,SO2是还原产物 | |
| C. | lmolCuFeS2反应转移电子为13mol | |
| D. | 该反应的所有产物均既是氧化产物,又是还原产物 |
| A. | Au-e-═Au+ | B. | O2+2H2O+4e-═4OH- | ||
| C. | Au-e-+2CN-═Au(CN)2- | D. | 2H2O+2e-═2OH-+H2 |
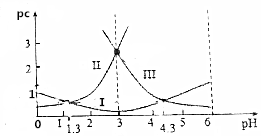 草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )
草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )| A. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| B. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)一定不变 | |
| C. | 草酸的电离常数Ka1=10-1.3 | |
| D. | $\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$=10-3 |
| A. | 无法判断该溶液中是否含有K+ | |
| B. | 该溶液中一定含有K+、SiO32-,可能含有CO32- | |
| C. | 该溶液中无SO32-,一定含有CO32- | |
| D. | 该溶液中可能含有K+和CO32- |
| A. | 在化合物CaCl2中,除了有Ca2+与Cl-之间的离子键外,还有两个Cl-之间的共价键 | |
| B. | 碘受热升华时共价键被破坏 | |
| C. | 熔化状态下能导电的化合物中一定存在离子键 | |
| D. | 离子化合物中可能含有共价键,共价化合物中可能含有离子键 |
| A. | $\frac{71b}{161(b+36a)}$×100% | B. | $\frac{71}{161}$×100% | ||
| C. | $\frac{b}{b+36a}$×100% | D. | $\frac{71b}{161(b+18a)}$×100% |