题目内容
15.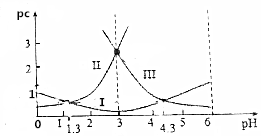 草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )
草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示,下列说法中不正确的是( )| A. | pH=4时,c(HC2O4-)>c(C2O42-) | |
| B. | c(H2C2O4)+c(HC2O4-)+c(C2O42-)一定不变 | |
| C. | 草酸的电离常数Ka1=10-1.3 | |
| D. | $\frac{c({C}_{2}{{O}_{4}}^{2-})•c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$=10-3 |
分析 H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-,PH增加促进电离平衡正向移动,所以由图可知:曲线Ⅰ是HC2O4-的物质的量浓度的负对数,曲线Ⅱ是H2C2O4的物质的量浓度的负对数,曲线Ⅲ是C2O42-的物质的量浓度的负对数,在PH=1.3点pc(HC2O4-)=pc(H2C2O4),所以c(HC2O4-)=c(H2C2O4),而PH=4.3点pc(HC2O4-)=pc(C2O42-)即c(HC2O4-)=c(C2O42-),由此分析解答.
解答 解:A、pH=4时,pc(C2O42-)>pc(HC2O4-),所以c(HC2O4-)>c(C2O42-),故A正确;
B.在PH=1.3点pc(HC2O4-)=pc(H2C2O4),所以c(HC2O4-)=c(H2C2O4),而PH=4.3点pc(HC2O4-)=pc(C2O42-)即c(HC2O4-)=c(C2O42-),所以说明c(H2C2O4)+c(HC2O4-)+c(C2O42-)不一定不变,故B错误;
C.在PH=1.3点pc(HC2O4-)=pc(H2C2O4),Ka1=$\frac{c(H{C}_{2}{{O}_{4}}^{-})c({H}^{+})}{c({H}_{2}{C}_{2}{O}_{4})}$=c(H+)=10-1.3,故C正确;
D.$\frac{c({C}_{2}{{O}_{4}}^{2-})c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$=$\frac{c({C}_{2}{{O}_{4}}^{2-})c({H}_{2}{C}_{2}{O}_{4})}{{c}^{2}(H{C}_{2}{{O}_{4}}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{K{a}_{2}}{K{a}_{1}}$=$\frac{1{0}^{-4.3}}{1{0}^{-1.3}}$=10-3,故D正确;
故选B.
点评 本题考查酸碱混合物的定性判断和计算,侧重于学生的分析能力和计算能力的考查,注意把握图象的含义,注意对平衡常数的理解与灵活运用,题目难度中等.

| A. | 加入少量W,逆反应速率增大,平衡左移 | |
| B. | 升高温度,混合气体的平均相对分子质量减小 | |
| C. | 加入Z,平衡左移,反应达到新的平衡时,体系中X的百分含量减小 | |
| D. | 反应达到平衡后再加入X,平衡右移,△H增大 |
| A. | NaCl溶液中滴加AgNO3溶液 | B. | Na2CO3溶液中滴加盐酸 | ||
| C. | CH3COOH溶液中滴加氨水 | D. | CuSO4溶液中滴加Ba(OH)2溶液 |
| A. | 某物质灼烧时,焰色反应为黄色,该物质一定是钠的化合物 | |
| B. | 向10mL0.05mol/LKAl(SO4)2溶液中滴加10mL0.1mol/LBa(OH)2溶液,反应后铝元素的主要存在形式是Al3+和Al(OH)3 | |
| C. | AlCl3和NaOH;HCl和NaAlO2;Na2CO3和HCl都可以不用其他试剂能鉴别出来 | |
| D. | 下列四个变化中①④可以通过一步实验直接完成①AlO2-→Al3+②Al2O3→Al(OH)3③Al3+→AlO2-④AlCl3→Al(OH)3 |
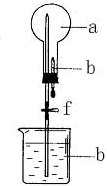 在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )
在如图所示装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,然后打开弹簧夹f,烧瓶中的液体b呈喷泉状喷出,最终红色液体几乎充满烧瓶,则a和b可能是( )| a(干燥气体) | b(液体) | |
| A | NH3 | 紫色石蕊水溶液 |
| B | Cl2 | 紫色石蕊水溶液 |
| C | HCl | 酚酞 |
| D | NH3 | 酚酞 |
| A. | A | B. | B | C. | C | D. | D |
