题目内容
 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO
电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO2- 4 |
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:
(3)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是
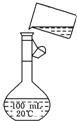
(4)为检验精盐纯度,需配制150mL 0.2mol/L NaCl(精盐)溶液如图是该同学转移溶液的示意图,图中的两处错误是:
若在定容时仰视,则所配溶液的浓度
考点:物质的分离、提纯的基本方法选择与应用
专题:实验设计题
分析:(1)操作a是通过过滤除去不溶性杂质的操作,实现固体和溶液分离的方法是过滤,依据过滤装置回答需要的仪器;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
(3)氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(4)实验室没有150mL容量瓶,应用250mL,注意溶液时要用玻璃棒引流,读数时应平视,仰视可导致溶液体积偏大,如定容不慎超过刻度线,应重新配制.
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
(3)氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(4)实验室没有150mL容量瓶,应用250mL,注意溶液时要用玻璃棒引流,读数时应平视,仰视可导致溶液体积偏大,如定容不慎超过刻度线,应重新配制.
解答:
解:(1)过滤需要的仪器有烧杯、漏斗、玻璃棒,故答案为:漏斗;玻璃棒;
(2)有效除去Ca2+、Mg2+、Fe3+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、Fe3+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
故答案为:BaCl2、Na2CO3、NaOH(或NaOH、BaCl2、Na2CO3);
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:将使沉淀又溶解引入杂质;
(4)实验室没有150mL容量瓶,应用250mL,注意溶液时要用玻璃棒引流,读数时应平视,仰视可导致溶液体积偏大,溶液浓度偏低,如定容不慎超过刻度线,应重新配制,
故答案为:容量瓶规格错误、没用玻璃棒引流;小于;重新配制.
(2)有效除去Ca2+、Mg2+、Fe3+、SO42-,应注意碳酸钠在钡试剂之后,是为除去过量的钡离子,而Mg2+、Fe3+、SO42-除杂不分先后,则试剂加入顺序为NaOH-BaCl2-Na2CO3或BaCl2-NaOH-Na2CO3,
故答案为:BaCl2、Na2CO3、NaOH(或NaOH、BaCl2、Na2CO3);
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:将使沉淀又溶解引入杂质;
(4)实验室没有150mL容量瓶,应用250mL,注意溶液时要用玻璃棒引流,读数时应平视,仰视可导致溶液体积偏大,溶液浓度偏低,如定容不慎超过刻度线,应重新配制,
故答案为:容量瓶规格错误、没用玻璃棒引流;小于;重新配制.
点评:本题考查较为综合,涉及物质分离提纯、除杂以及溶液的配制等知识,为高频考点,把握除杂不能引入新的杂质及试剂的添加顺序为解答的关键,注意除杂试剂过量,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、碳酸钙溶解于稀硝酸中:CO32-+2H+═CO2↑+H2O |
| B、氯化钠溶液中滴加硝酸银溶液:Cl-+AgNO3═AgCl↓+NO3- |
| C、盐酸中滴入氨水:H++OH-═H2O |
| D、碳酸氢钠溶液与NaOH溶液混合:HCO3-+OH-═CO32-+H2O |
与反应Cl2+SO2+2H2O=H2SO4+2HCl中水的作用完全相同的是( )
A、2H2O
| ||||
| B、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
| C、2F2+2H2O=4HF+O2↑ | ||||
| D、2Na+2H2O=2NaOH+H2↑ |
长期以来,人们一直认为氟的含氧酸不可能存在,但是自1971年两位美国科学家斯图查尔和阿佩里曼成功地合成次氟酸后,这种观点强烈的动摇了.他们在0℃以下将氟气从细冰上面通过,得到了毫克量的次氟酸.已知次氟酸的分子组成与次氯酸相似,且次氟酸与热水剧烈反应,生成既有氧化性又有还原性的物质的溶液.下列说法不正确的是( )
| A、次氟酸分子中原子间以共价键相结合 |
| B、次氟酸分解会产生F2 |
| C、次氟酸与热水反应可能有H2O2生成 |
| D、次氟酸的酸性可能比次氯酸强 |
CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子化合物,请通过对CaC2制C2H2的反应进行思考,从中得到启示,判断下列产物正确的是( )
| A、ZnC2水解生成乙炔C2H2 |
| B、Al4C3水解生成丙炔C3H4 |
| C、Mg2C3水解生成丙烯C3H6 |
| D、Li2C2水解生成乙烯C2H4 |