题目内容
1.在两个恒容的密闭容器中进行下列两个可逆反应:(甲)2NO2(g)?2NO(g)+O2(g)
(乙)H2(g)+l2(g)?2Hl(g)能够表明(甲)、(乙)俩个反应都达到了化学平衡状态的是( )
| A. | 恒温时压强不再改变的状态 | |
| B. | 体系温度不在改变的状态 | |
| C. | 恒温时混合气体的密度不再改变的状态 | |
| D. | 混合气体的平均相对分子质量不再改变的状态 |
分析 当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量不变,注意乙反应是一个反应前后气体体积不变的化学反应,所以不能用压强判断平衡.
解答 解:A、恒温时,气体压强不再改变,乙反应的两边气体的体积相同且都是气体,压强始终不变,所以压强不变无法判断乙是否达到平衡状态,故A错误;
B、反应体系中温度保持不变,说明正逆反应速率相等,达到了平衡状态,故B正确;
C、混合气体密度不变,由于甲、乙反应的两边都是气体,容器的容积不变,所以密度始终不变,无法判断甲、乙是否达到平衡状态,故C错误;
D、混合气体平均相对分子质量不再改变,由于乙反应的两边气体的体积相同且都是气体,压强始终不变,所以平均相对分子质量始终不变,无法判断乙反应是否达到平衡状态,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意反应前后气体体积不变的化学反应不能用压强来判断是否达到平衡状态.

练习册系列答案
相关题目
11.下列叙述中,正确的是( )
| A. | 自然界中存在大量单质硅 | |
| B. | 石英、水晶、硅石的主要成分都是二氧化硅 | |
| C. | 常温下硅性质活泼,能与氯气、强酸反应 | |
| D. | 自然界中的硅是以二氧化硅或硅酸盐的形式存在 |
12.不能使橙色溴水变为无色的是( )
| A. | NaOH溶液 | B. | 用CCl4多次萃取 | C. | 锌粉 | D. | KI溶液 |
9.下列有关说法正确的是( )
| A. | 某放热反应能自发进行.因此该反应是熵增反应 | |
| B. | Fe(OH)3胶体无色、透明,不能透过滤纸 | |
| C. | 单质硅是将太阳能转变为电能的常用材料 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
16.用电解法提取氯化铜溶液中的铜,方案设计或电极反应式书写正确的是( )
| A. | 用碳棒连接电源的正极,另一电极用铜片 | |
| B. | 用铜片连接电源的正极,另一电极用铂片 | |
| C. | 阳极反应式为:Cu-2e═Cu2 | |
| D. | 阴极反应式为:2H++2e═H2↑ |
6.有Al、CuO、Fe2O3组成的混合物共100g,放入500mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250mL2.0 mol/L的NaOH溶液时,得到的沉淀最多.上述盐酸溶液的液度为( )
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 2.0mol/L | D. | 3.0mol/L |
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 L CCl4中含有的分子数目为0.25NA | |
| B. | 标准状况下,体积为22.4L的物质所含微粒数是NA | |
| C. | 常温常压下,0.5 mol NH3中含有的原子数目为2NA | |
| D. | 500mL1 mol•L-1 K2SO4溶液中含有的k+数目为2NA |
5. 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )| A. | NaOH | B. | H2SiO3 | C. | HNO2 | D. | H2SO4 |
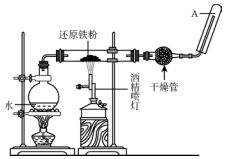 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.