题目内容
3.化合物甲常大量用于面粉的消毒与漂白,常温下呈液态,极易分解得两种气体单质A和B. 现有12.05g化合物甲,完全分解后得标准状况下4.48L混合气体.将所得混合气体通过足量NaOH溶液,最后只余标准状况下1.12L气体单质A共1.40g.请回答:
(1)甲的化学式是NCl3.
(2)实验室可通过石墨碳棒为电极电解NH4Cl和盐酸的混合溶液来制备甲,电解时发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
(3)①甲遇水蒸气可形成一种常见的漂白性物质C 同时放出气体D,该反应为非氧化还原,写出甲与水反应的化学方程式为NCl3+3H2O=NH3+3HClO.
②D在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式2NH3+Fe2O3=N2+2Fe+3H2O
③有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)取固体生成物ag与足量盐酸反应,测定生成气体标况的体积为VL,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.或取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成.
分析 现有12.05g化合物甲,完全分解后得标准状况下4.48L混合气体.混合气体物质的量为0.2mol,将所得混合气体通过足量NaOH溶液,最后只余标准状况下1.12L气体单质A共1.40g,气体A的摩尔质量M(A)=$\frac{1.4g}{\frac{1.12}{22.4}mol}$=28g/mol,则单质A为N2,单质B摩尔质量M(B)=$\frac{12.05g-1.4g}{0.2mol-0.05mol}$=71g/mol,判断B为Cl2,则甲化合物为NCl3,
(1)上述计算得到甲的化学式;
(2)石墨碳棒为电极电解NH4Cl和盐酸的混合溶液来制备甲,依据电解原理可知阳极上是氯化铵失电子生成NCl3,阴极是氢离子得到电子生成氢气;
(3)①甲遇水蒸气可形成一种常见的漂白性物质C 同时放出气体D,该反应为非氧化还原,依据原子守恒得到NCl3和水反应生成HClO和氨气;
②D为氨气在高温条件下能还原Fe2O3,生成两种单质为氮气和铁,依据原子守恒配平书写化学方程式;
③依据固体为铁,若混有氧化亚铁,利用其余酸反应生成的气体体积庞大;或用氢气或一氧化碳还原固体,依据固体质量变化判断或固体在硫酸铜溶液中铁全部溶解,过滤得到滤渣溶于稀盐酸后加入KSCN溶液无变化,加入氯水呈红色证明含氧化亚铁等试验原理设计实验验证.
解答 解:现有12.05g化合物甲,完全分解后得标准状况下4.48L混合气体.混合气体物质的量为0.2mol,将所得混合气体通过足量NaOH溶液,最后只余标准状况下1.12L气体单质A共1.40g,气体A的摩尔质量M(A)=$\frac{1.4g}{\frac{1.12}{22.4}mol}$=28g/mol,则单质A为N2,单质B摩尔质量M(B)=$\frac{12.05g-1.4g}{0.2mol-0.05mol}$=71g/mol,判断B为Cl2,则甲化合物为NCl3,
(1)上述计算得到甲的化学式NCl3,
故答案为:NCl3;
(2)石墨碳棒为电极电解NH4Cl和盐酸的混合溶液来制备甲,依据电解原理可知阳极上是氯化铵失电子生成NCl3,阴极是氢离子得到电子生成氢气,反应的化学方程式为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑,
故答案为:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;
(3)①甲遇水蒸气可形成一种常见的漂白性物质C 同时放出气体D,该反应为非氧化还原,依据原子守恒得到NCl3和水反应生成HClO和氨气,反应的化学方程式为:NCl3+3H2O=NH3+3HClO,
故答案为:NCl3+3H2O=NH3+3HClO;
②D为氨气在高温条件下能还原Fe2O3,生成两种单质为氮气和铁,依据原子守恒配平书写化学方程式为:2NH3+Fe2O3=N2+2Fe+3H2O,
故答案为:2NH3+Fe2O3=N2+2Fe+3H2O;
③依据固体为铁,若混有氧化亚铁,利用其余酸反应生成的气体体积庞大;或用氢气或一氧化碳还原固体,依据固体质量变化判断或固体在硫酸铜溶液中铁全部溶解,过滤得到滤渣溶于稀盐酸后加入KSCN溶液无变化,加入氯水呈红色证明含氧化亚铁等试验原理设计实验验证;具体实验设计为:取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.或取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成,
故答案为:取固体生成物a g与足量盐酸反应,测定生成气体标况的体积为V L,若V<$\frac{a}{56}×22.4$,则含FeO,反之则无;或者取一定质量固体生成物与足量H2(或CO)共热充分反应,若质量减少则含FeO,反之则无.或取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加 KSCN溶液无现象,再滴加氯水,若溶液呈红色,则证明有FeO生成.
点评 本题考查了物质组成的计算分析和化学式判断,主要是化学方程式书写、物质检验等知识,注意题干信息的分析应用,题目难度中等.

 全能练考卷系列答案
全能练考卷系列答案| A. | X、Y两种元素形成的化合物中原子个数比一定为2:1 | |
| B. | Z、Y两种元素形成的化合物中只能含有离子键 | |
| C. | W元素形成的单质熔点很高,是一种优良的耐火材料 | |
| D. | Z、W、Q三种元素的最高价氧化物对应的水化物能两两反应 |
| A. | 19gNHD2和19gNH2T中含有的中子数均为9NA | |
| B. | 1molCnH2n+2中含有的共用电子对数为(3n+1)NA | |
| C. | 2 mol Na2O2有的阴离子数为4NA | |
| D. | 2 mol SO2和1 molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
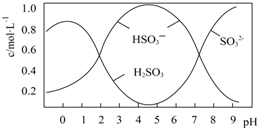 葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )
葡萄酒常用Na2S2O5做抗氧化剂,25℃时,将0.5molNa2S2O5溶于水配成1L溶液,该溶液pH=4.5,溶液中部分微粒不正确的是( )| A. | Na2S2O5溶于水的化学方程式:Na2S2O5+H2O=2NaHSO3 | |
| B. | 由图形可知,25℃时,HSO3-的水解平衡常数约为10-12 | |
| C. | 当溶液pH小于0.5后,图中曲线变化的原因可能是H2SO3被部分氧化 | |
| D. | 向溶液中加入碱性物质使溶液pH升高的过程中,一定存在如下关系:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-) |
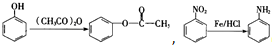 ,(具有还原性,极易被氧化)
,(具有还原性,极易被氧化) .
. .
.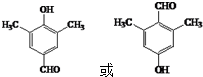 (写出其中一种结构简式).
(写出其中一种结构简式).
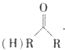 $\stackrel{HCN}{→}$
$\stackrel{HCN}{→}$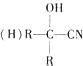 $→_{H+}^{H_{2}O}$
$→_{H+}^{H_{2}O}$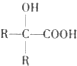
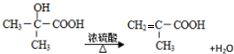
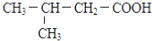 B.
B.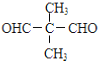 C.
C.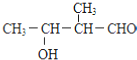 D.
D.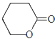
 .
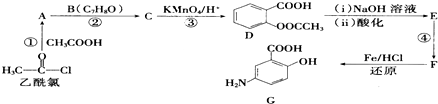
. )可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式)
)可以生物降解,实现在自然界中的循环,是理想的绿色高分 子材料.请以乙醛为有机原料,设计聚乳酸的合成路线.(无机试剂任选,合成路线参照“已 知”中的书写形式) .
.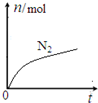 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: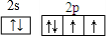 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).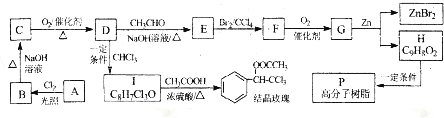
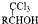
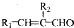 (R、R1、R2代表烃基或氢原子)
(R、R1、R2代表烃基或氢原子)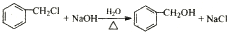 ;
;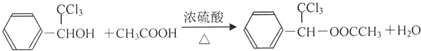 ;
;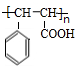 ;
;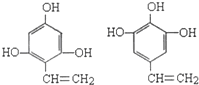 .
.