题目内容
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(标准状况下)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)( )

C
【解析】
试题分析:含有0.2mol NaOH和0.1mol Ca(OH)2的溶液中离子总的物质的量为0.2mol×2+0.1mol×3=0.7mol,n(CO2)=6.72L÷22.4L/mol=0.3mol,通入含有0.2molNaOH和0.1molCa(OH)2的溶液中,相当于首先发生:Ca2++2OH-+CO2=CaCO3↓,该阶段0.1molCa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、0.2molNa+,生成0.1molCaCO3;然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;再发生CO32-+CO2+H2O=2HCO3-,0.1molCO32-完全反应消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,此时溶液中离子为0.4mol,二氧化碳反应完全,CaCO3不发生反应,上述图象中C符合,故选C。
考点:考查离子方程式的计算

(13分)1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+ NH4+ Al3+ K+ |
可能大量含有的阴离子 | Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
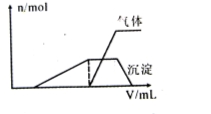
则该溶液中确定含有的离子有 ;
不能确定是否含有的阳离子有 ,
要确定其存在可补充做的实验是 ;
肯定不存在的阴离子有 。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
n (Cl-) | 1.25mol | 1.5mol | 2mol |
n (Br-) | 1.5mol | 1.4mol | 0.9mol |
n(I-) | amol | 0 | 0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ;
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 ;