题目内容
H2O2一种常用的绿色氧化剂,在化学研究中应用广泛

(1)H2O2分解过程中能量变化如图(a)所示,试判断该反应为 反应 (吸热或放热)
(2)①已知:Fe3+催化H2O2分解的机理可分两步反应进行,第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+完第二步反应的离子方程式:□Fe2++□H2O2+□ =□ +
②按图(b)装置(A、B)瓶中已允有NO2体.2NO2(g)?N2O4(g)△H<0察到b瓶中气体颜色比a瓶中的 (填“深”或“浅”),原因
(3)空气阴气阴极法电解制备H2O2装置如图(c)所示主要原理是在碱性电解质溶液中,利用空气中的O2反应后刻的到H2O和稀碱的混合物,写出阴极电极反应式
(4)用 H2O2和H2SO4混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式
(5)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/L-1 H2SO4溶液处理,测得不同温度下同的平均溶解速率(见下表)
当温度高于40℃铜的溶解平均溶解速率随着反应温度的升高而下降,其主要原因之一是
.

(1)H2O2分解过程中能量变化如图(a)所示,试判断该反应为
(2)①已知:Fe3+催化H2O2分解的机理可分两步反应进行,第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+完第二步反应的离子方程式:□Fe2++□H2O2+□
②按图(b)装置(A、B)瓶中已允有NO2体.2NO2(g)?N2O4(g)△H<0察到b瓶中气体颜色比a瓶中的
(3)空气阴气阴极法电解制备H2O2装置如图(c)所示主要原理是在碱性电解质溶液中,利用空气中的O2反应后刻的到H2O和稀碱的混合物,写出阴极电极反应式
(4)用 H2O2和H2SO4混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式
(5)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/L-1 H2SO4溶液处理,测得不同温度下同的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率(×10-3mol.min-1 | 7.34 | 3.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
考点:氧化还原反应方程式的配平,氧化还原反应,吸热反应和放热反应,化学反应速率的影响因素,电解原理
专题:
分析:(1)反应物总能量高于生成物总能量反应为放热反应;
(2)①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应的方程式;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动;
(3)氧气在阴极还原得到H2O2和稀碱的混合物;
(4)铜、双氧水、硫酸反应生成硫酸铜和水;
(5)当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
(2)①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应的方程式;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动;
(3)氧气在阴极还原得到H2O2和稀碱的混合物;
(4)铜、双氧水、硫酸反应生成硫酸铜和水;
(5)当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
解答:
解:(1)由图a可知,1mol过氧化氢总能量高于1mol水与0.5mol氧气总能量,故过氧化氢分解是放热反应,故答案为:放热;
(2)①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2;1;2H+;2Fe3+;2H2O;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深; 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动;
(3)氧气在阴极还原得到H2O2和稀碱的混合物,电极反应式为:O2+2e-+2H2O=H2O2+2OH-,故答案为:O2+2e-+2H2O=H2O2+2OH-;
(4)铜、双氧水、硫酸反应生成硫酸铜和水,离子方程式为:H2O2+2H++Cu=Cu2++2H2O,故答案为:H2O2+2H++Cu=Cu2++2H2O;
(5)温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
(2)①总反应为2H2O2═2H2O+O2↑,第一步反应为2Fe3++H2O2═2Fe2++O2↑+2H+,则总反应减去第一步反应为第二步反应2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2;1;2H+;2Fe3+;2H2O;
②由图b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以图c中,右侧烧杯的温度高于左侧,升高温度使2NO2(红棕色)?N2O4(无色)△H<0,向逆反应方向移动,即向生成NO2移动,故B瓶颜色更深,
故答案为:深; 右侧烧杯由于H2O2分解放热水温升高,使上述平衡向逆向移动;
(3)氧气在阴极还原得到H2O2和稀碱的混合物,电极反应式为:O2+2e-+2H2O=H2O2+2OH-,故答案为:O2+2e-+2H2O=H2O2+2OH-;
(4)铜、双氧水、硫酸反应生成硫酸铜和水,离子方程式为:H2O2+2H++Cu=Cu2++2H2O,故答案为:H2O2+2H++Cu=Cu2++2H2O;
(5)温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
点评:本题考查电解原理、反应速率影响因素、化学平衡移动等,熟悉相关知识是解题关键,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 |
| B、分子式为C4H7ClO2,可与NaHCO3产生CO2的有机物可能结构有3种 |
C、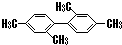 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 |
D、1mol有机物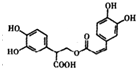 一定条件下能和7molNaOH反应. 一定条件下能和7molNaOH反应. |
下列说法正确的是( )
| A、可用饱和溴水除去苯中的苯酚 |
| B、丙烯加聚时可形成顺反两种聚合物 |
| C、常压下的沸点:1-丙醇>乙醇>丙烷 |
| D、蔗糖及其水解产物均能发生银镜反应 |
下列说法错误的是( )
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol?L-1NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中不正确的是( )
| A、当金属全部溶解时,失去电子的物质的量为0.3 mol |
| B、当金厲全部溶解时收集NO气体体积为2.24 L |
| C、当生成的沉淀量达最大时,消耗NaOH溶液的体积V≥100 mL |
| D、参加反应的金属总质量为9.6 g>m>3.6 g |
用铂作电极电解1000mL 0.1mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4g.下列有关叙述正确的是(NA代表阿伏加德罗常数的值)( )
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
如图为不同温度下水的电离平衡曲线,巳知pOH=-lgc(OH -),下列说法正确的是( )


| A、T1和T2的关系是:T1>T2 |
| B、Kw的关系是:B>C>A=D=E |
| C、A点到D点:加入少量酸可实现 |
| D、T2时:pH=2的硫酸与pH=12的NaOH溶液等体枳混合,溶液呈中性 |
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g)?2NH3(g)△H<0,相关数据如下表所示:下列说法正确的是 ( )
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K= | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙>K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
设NA为阿伏加德罗常数的数值.下列说法正确的是( )
| A、0.1 mol?L-1的NaF溶液中所含F-的数目小于0.1NA |
| B、标准状况下,2.24 L乙醇中含有的C-H键数目为0.5NA |
| C、0.l mol O3和O2的混合气体中含氧原子数目为0.2NA |
| D、0.1 mol NA完全被氧化生成Na2O2,转移电子的数目为0.1NA |