题目内容
(1)下列反应中氯元素全部被氧化的是 ,全部被还原的是 ,部分被氧化的是 ,部分被还原的是 .
A.4HCl+MnO2
MnCl2+Cl2↑+2H2O
B.MgCl2
Mg+Cl2↑
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
D.2KClO3
2KCl+3O2↑
E.Cl2+H2O=HCl+HClO
(2)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
①反应中 元素被氧化, 是氧化剂;
②用单线桥标出电子转移方向和数目 ;
③反应产物中,所得氧化产物与还原产物物质的量之比为 .
A.4HCl+MnO2
| ||
B.MgCl2
| ||
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
D.2KClO3
| 催化剂 |
| 加热 |
E.Cl2+H2O=HCl+HClO
(2)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
①反应中
②用单线桥标出电子转移方向和数目
③反应产物中,所得氧化产物与还原产物物质的量之比为
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)Cl元素的化合价升高被氧化,Cl元素的化合价降低被还原,结合原子守恒及反应分析;
(2)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O中,I元素的化合价降低,S元素的化合价升高,该反应中转移10e-,以此来解答.
(2)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O中,I元素的化合价降低,S元素的化合价升高,该反应中转移10e-,以此来解答.
解答:
解:A.4HCl+MnO2
MnCl2+Cl2↑+2H2O中Cl元素的化合价升高被氧化,则4molHCl反应只有2mol被氧化;
B.MgCl2
Mg+Cl2↑中,Cl元素的化合价升高被氧化,且全部被氧化;
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中Cl元素的化合价升高被氧化,则16molHCl反应只有10mol被氧化;
D.2KClO3
2KCl+3O2↑中Cl元素的化合价降低,全部被还原;
E.Cl2+H2O=HCl+HClO中,Cl元素的化合价既升高又降低,则部分被氧化,部分被还原;
故答案为:B;D;ACE;E;
(2)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O中,
①I元素的化合价降低,则NaIO3为氧化剂,S元素的化合价升高被氧化,故答案为:S;NaIO3;
②该反应中转移10e-,单线桥标出电子转移方向和数目为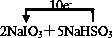 ,故答案为:
,故答案为: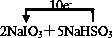 ;
;
③氧化产物为NaHSO4、Na2SO4,还原产物为I2,所得氧化产物与还原产物物质的量之比为5:1,故答案为:5:1.
| ||
B.MgCl2
| ||
C.2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中Cl元素的化合价升高被氧化,则16molHCl反应只有10mol被氧化;
D.2KClO3
| 催化剂 |
| 加热 |
E.Cl2+H2O=HCl+HClO中,Cl元素的化合价既升高又降低,则部分被氧化,部分被还原;
故答案为:B;D;ACE;E;
(2)2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O中,
①I元素的化合价降低,则NaIO3为氧化剂,S元素的化合价升高被氧化,故答案为:S;NaIO3;
②该反应中转移10e-,单线桥标出电子转移方向和数目为
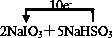 ,故答案为:
,故答案为: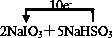 ;
;③氧化产物为NaHSO4、Na2SO4,还原产物为I2,所得氧化产物与还原产物物质的量之比为5:1,故答案为:5:1.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意从化合价角度分析,题目难度不大.

练习册系列答案
相关题目
下列各组在溶液中的反应,反应物量不同,离子方程式不同且现象不同的是( )
| A、Ba(OH)2与NaHSO4 |
| B、Ba(OH)2与H2SO4 |
| C、HCl与Na2CO3 |
| D、Ca(HCO3)2与NaOH |
下列事实一定能证明HNO2是弱电解质的是( )
| A、常温下HNO2溶液的pH小于7 |
| B、用HNO2溶液做导电实验,灯泡很暗 |
| C、HNO2和NaCl溶液不能发生反应 |
| D、用1L0.1 mol/L HNO2溶液和2L0.1mol/LNaOH溶液做导电实验,后者灯泡更亮 |
下列说法中错误的是( )
| A、CO2、SO3都是极性分子 |
| B、KF是离子化合物,HF为共价化合物 |
| C、在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| D、PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |

 (1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=
(1)T℃时,向1L密闭容器中投入1mol CH4和1mol H2O(g),平衡时c(CH4)=0.5mol?L-1.该温度下反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数K=