题目内容
2.紫菜中含有比较丰富的碘,通常以KI形式存在.KMnO4是强氧化剂,能氧化H2O2、SO32-、Br-、I-、S2-、Fe2+等.某化学兴趣小组拟对市面上销售的某品牌紫菜进行碘的提取和含碘量测定,设计了如下实验步骤:A.将灼烧后的紫菜灰溶于水,配成悬浊液,过滤
B.将水溶液和试剂甲加入分液漏斗中,震荡后静置,放出下层溶液备用
C.取干燥的紫菜m g于坩埚中灼烧
D.向滤液中滴加少量硫酸酸化的3%的H2O2溶液a ml,充分反应
E.对下层溶液进行某操作,得到碘单质并回收试剂甲
(1)对上述实验步骤进行合理的排序:CADBE.
(2)步骤D中发生的离子反应为:2H++H2O2+2I-=I2+2H2O.
小组中甲同学分析实验时认为步骤D中的H2O2可能有剩余,故取少量酸性高锰酸钾溶液,向其中滴加D中反应后的溶液,若溶液的紫色褪去,则说明H2O2还剩余.小组乙同学认为该结论存在不严谨的地方,请指出你认为不严谨的地方:若步骤D中I-未反应完,剩余的I-也可使高锰酸钾溶液褪色
(3)步骤E中“某操作”是蒸馏.
(4)若实验用的H2O2溶液的密度为1g/cm3,假定所加H2O2溶液恰好完全反应完,则该紫菜中碘的含量可表示为:$\frac{\frac{a×3%}{34}×2×127}{\frac{m}{100}}$g/100g(结果不化简)
分析 (1)碘的提取和含碘量测定应先:C.取干燥的紫菜m g于坩埚中灼烧,A.将灼烧后的紫菜灰溶于水,配成悬浊液,过滤;D.向滤液中滴加硫酸酸化的3%的H2O2溶液a mL,充分反应;B.将水溶液和试剂甲加入分液漏斗中,震荡后静置,放出下层溶液备用;E.对下层溶液进行某操作,得到碘单质并回收试剂甲;
(2)步骤D中发生的是过氧化氢氧化碘离子为碘单质;实验过程中碘离子、过氧化氢都可以和高锰酸钾溶液发生反应使之褪色;
(3)对下层溶液进行某操作,得到碘单质并回收试剂甲,利用物质的沸点不同通过蒸馏方法得到;
(4)所加H2O2溶液恰好完全反应完全,依据化学方程式定量关系计算碘离子物质的量计算碘元素质量分数.
解答 解:(1)碘的提取和含碘量测定应先:C.取干燥的紫菜m g于坩埚中灼烧,A.将灼烧后的紫菜灰溶于水,配成悬浊液,过滤;D.向滤液中滴加硫酸酸化的3%的H2O2溶液a mL,充分反应;B.将水溶液和试剂甲加入分液漏斗中,震荡后静置,放出下层溶液备用;E.对下层溶液进行某操作,得到碘单质并回收试剂甲,实验步骤进行合理的排序为:CADBE;
故答案为:CADBE;
(2)步骤D中发生的是过氧化氢氧化碘离子为碘单质,反应的离子方程式为:2H++H2O2+2I-=I2+2H2O;实验过程中碘离子、过氧化氢都可以和高锰酸钾溶液发生反应使之褪色;步骤D中的H2O2可能有剩余,取少量酸性高锰酸钾溶液,向其中滴加D中反应后的溶液,若溶液褪色则说明还剩余H2O2.小组乙同学认为该结论存在不严谨的地方,请指出你认为不严谨的地方,若步骤D中I-未反应完,剩余的I-也可使高锰酸钾溶液褪色;
故答案为;2H++H2O2+2I-=I2+2H2O;若步骤D中I-未反应完,剩余的I-也可使高锰酸钾溶液褪色;
(3)对下层溶液进行某操作,得到碘单质并回收试剂甲,利用物质的沸点不同通过蒸馏方法得到;
故答案为:蒸馏;
(4)所加H2O2溶液恰好完全反应完全,依据化学方程式定量关系计算碘离子物质的量计算碘元素质量分数;
2H++H2O2+2I-=I2+2H2O
1 2
aml×1g/cm3×3% n
n=$\frac{aml×1g/c{m}^{3}×3%}{34g/mol}×2$;
则该紫菜中碘的含量可表示=$\frac{\frac{a×3%}{34}mol×2×127g/mol}{\frac{m}{100}g}$=$\frac{\frac{a×3%}{34}×2×127}{\frac{m}{100}}$;
故答案为:$\frac{\frac{a×3%}{34}×2×127}{\frac{m}{100}}$.
点评 本题考查物质含量的测定,为高考常见题型,题目涉及对实验原理与操作步骤的理解、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案| A. | 钠原子与氯原子反应生成NaCl后,其结构的稳定性增强 | |
| B. | 阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距离相当小 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 任何离子键在形成的过程中必定有电子的得与失 |
 硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )
硝基胍是硝化纤维火药、硝化甘油火药的掺合剂、固体火箭推进剂的重要组分,其结构如图所示(“→”是一种特殊的共价单键).下列有关硝基胍的说法正确的是( )| A. | 硝基胍分子中只含极性键,不含非极性键 | |
| B. | 硝基胍中有C、H、O、N四种元素,属于氨基酸 | |
| C. | 硝基胍分子中σ键与π键的个数比是5:1 | |
| D. | 10.4 g该物质含有1.1×6.02×1023个原子 |
 ,则x、y及该原子3p能级上的电子数分别为( )
,则x、y及该原子3p能级上的电子数分别为( )| A. | 18、6、4 | B. | 22、8、6 | C. | 26、14、6 | D. | 15、3、1 |

| A. | 若它们均为金属元素,则X、Y与氧元素组成的物质一定是碱性氧化物 | |
| B. | 若它们的原子最外层电子数之和为11,则它们均为非金属元素 | |
| C. | 若它们均不是金属元素,则非金属性:Z>Y>X | |
| D. | Z元素的最高化合价不一定高于X元素的最高化合价 |
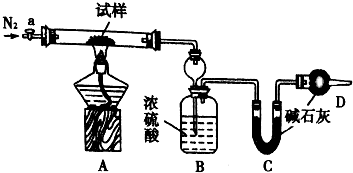 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
 氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.
氯氨是氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHC12和NC13),副产物少于其它水消毒剂.回答下列问题:
(1)①一氯胺(NH2Cl)的电子式为
 .
.②工业上可利用反应Cl2(g)+NH3(g)═NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的链能相同),则该反应的△H=+11.3 kJ/mol.
| 化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
| 键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),向容积均为1L的甲、乙两个恒温(反应温度分别为400℃、T℃)容器中分别加入2mol C12和2mol NH3,测得各容器中n(Cl2)随反应时间t的变化情况如下表所示:
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(Cl2)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(Cl2)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②该反应的△H< 0(填“>”或“<”),理由是温度越高,反应速率越快,平衡向吸热反应方向移动,其他条件相同时,T℃时的反应速率比400℃时的反应速率快,且乙容器中平衡时Cl2的转化率比甲容器中Cl2的转化率小.
③对该反应,下列说法正确的是AB (填选项字母).
A.若容器内气体密度不变,则表明反应达到平衡状态
B.若容器内C12和NH3物质的量之比不变,则表明反应达到平衡状态
C.反应达到平衡后,其他条件不变,在原容器中充入一定量氦气,Cl2的转化率增大
D.反应达到平衡后,其他条件不变,加入一定量的NHCl2,平衡向逆反应方向移动
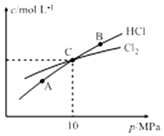
(3)在恒温条件下,2molCl2和1molNH3发生反应2Cl2(g)+NH3(g)?NHCl2(l)+2HCl(g),测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中Cl2转化率最高的是B 点(填“A”“B”或“C”).
②计算C点时该反应的压强平衡常数Kp(C)=0.5MPa(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
 ;
;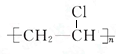 ,其反应类型为加聚反应.
,其反应类型为加聚反应.