题目内容
7.聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理.现用一定质量的铁的氧化物(如图)为原料来制取聚合硫酸铁,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe 2+.实验步骤如下: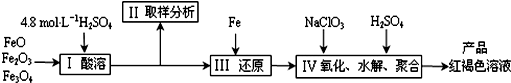
(1)实验室用18.4mol•L-1的浓硫酸配制250mL4.8mol•L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需250mL容量瓶、胶头滴管.
(2)在步骤(1)配制250mL4.8mol•L-1的硫酸溶液过程中,下列操作会使配置的溶液的浓度偏高的是BC
A.用量筒量取浓硫酸时,俯视读数
B.把量筒中的浓硫酸转移到烧杯中稀释后,用少量蒸馏水洗涤一下量筒内壁,同时把洗涤液也转移到烧杯中
C.稀释后的硫酸溶液及时用玻璃棒引流转移到容量瓶中
D.移夜时容量瓶内壁未干燥,残留有水
(3)写出步骤Ⅳ中用NaClO3氧化时的离子方程式6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O(提示:ClO3-转化为Cl-);已知1mol HNO3的价格为0.16元,1mol NaClO3的价格为0.45元,评价用HNO3代替NaClO3作为氧化剂的利弊,利是原料成本较低,弊是产生气体对大气有污染.
(4)为了分析产品聚合硫酸铁溶液中SO42-与Fe3+ 物质的量之比,有人设计了以下操作:
(a)取25mL聚合硫酸铁溶液,加入足量的BaCl2溶液,产生白色沉淀,白色沉淀经过过滤、洗涤、干燥后,称重,其质量为m g.
(b)另取25mL聚合硫酸铁溶液,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并配成250mL溶液,取该溶液25.00mL,用KMnO4酸性溶液滴定,到达终点时用去0.1000mol/L KMnO4标准溶液VmL.反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
回答下列问题:
①判断(a)步骤溶液中SO42-离子已沉淀完全的方法是取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全_;
②在(b)步骤中判断达到终点的现象是溶液由浅蓝色变为浅紫红色,且半分钟内不变色;
③聚合硫酸铁中SO42-与Fe3+的物质的量之比为$\frac{m}{233}$:$\frac{V}{200}$(用含m、V的代数式表示).
分析 (1)根据配制一定量分数溶液的步骤:计算、称量、溶解,确定所用的仪器;
(2)滴定过程中产生的误差依据滴定原理就是式分析,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,把产生的误差全部归纳为标准溶液消耗的体积判断产生的误差;
(3)根据氧化还原反应中化合价升降相等以及电荷守恒、质量守恒来解答,从环保和成本方面考虑;
(4)①判断SO42-离子已沉淀完全的方法是取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全;
②达到终点时高锰酸钾过量,溶液由浅蓝色变为浅紫红色,且半分钟内不变色;
③分别求出聚合硫酸铁中SO42-与Fe3+的物质的量(用含m、V的代数式表示).
解答 解:(1)配制一定量分数硫酸溶液需要的仪器有:胶头滴管、量筒、玻璃棒、烧杯.
故答案为:250mL容量瓶、胶头滴管;
(2)因滴定过程中产生的误差依据滴定原理就是式分析,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,
A.用量筒量取浓硫酸时,俯视读数,量取的浓硫酸体积减小,配制得到的溶液浓度减小,故A错误;
B.把量筒中的浓硫酸转移到烧杯中稀释后,用少量蒸馏水洗涤一下量筒内壁,同时把洗涤液也转移到烧杯中,避免了溶质的损失,故B正确;
C.稀释后的硫酸溶液及时用玻璃棒引流转移到容量瓶中,硫酸溶解放热形成的热溶液未经冷却,会导致溶液体积增大,冷却到常温下容量瓶中 溶液体积未达到刻度,溶液浓度增大,故C正确;
D.移液时容量瓶内壁未干燥,残留有水,对测定结果无影响,故D错误;
故答案为:BC;
(3)Fe2+由+2价升高到+3价,ClO3-中Cl的化合价从+5价降低到-1价,得6Fe2++ClO3-+H+--6Fe3++Cl-,由电荷守恒、质量守恒得:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O,从环保和成本方面考虑利是原料成本较低,弊是产生气体对大气有污染.
故答案为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O; 原料成本较低;产生气体对大气有污染;
(4))①判断SO42-离子已沉淀完全的方法是取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全,
故答案为:取上层清夜,滴加BaCl2溶液,若无沉淀产生,则溶液中SO42-已沉淀完全;
②达到终点时高锰酸钾过量,溶液由浅蓝色变为浅紫红色,且半分钟内不变色,
故答案为:溶液由浅蓝色变为浅紫红色,且半分钟内不变色
③25mL溶液中含聚合硫酸铁中SO42-的物质的量为:$\frac{m}{233}$mol,
设Fe3+的物质的量为x:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
1 5
0.1mol/L×0.001VL $\frac{x}{10}$
解得x=$\frac{V}{200}$mol,
聚合硫酸铁中SO42-与Fe3+的物质的量之比为$\frac{m}{233}$:$\frac{V}{200}$,
故答案为:$\frac{m}{233}$:$\frac{V}{200}$.
点评 本题以铁及其化合物为载体,以流程图形式考查了氧化还原反应知识、元素化合物的知识,注意风险过程和实验基本操作的分析,掌握基础是解题关键,题目难度中等.

| A. | SiO2与CaCl2溶液不反应,而CO2通入CaCl2溶液中可得到白色沉淀 | |
| B. | CO2通入到水玻璃中可以得到硅酸 | |
| C. | CO2与SiO2在物理性质上差别很大 | |
| D. | CO2和SiO2都是酸性氧化物,都能与NaOH溶液反应 |
| A. | 物质的量浓度相等的碳酸氢钡溶液和氢氧化钠溶液等体积混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作电极电解氯化镁溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氢钠溶液加入氯化铝溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
| A. |  图中△H1=△H2+△H3 | |
| B. |  如图在催化剂条件下,反应的活化能等于E1+E2 | |
| C. |  如图表示醋酸溶液滴定 NaOH 和氨水混合溶液的电导率变化曲线 | |
| D. |  如图可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量 |
| A. | 氢键比分子间作用力强,所以它属于化学键 | |
| B. | 分子内形成的氢键使物质的熔点和沸点升高 | |
| C. | 氨溶于水后氨分子和水分子之间形成了氢键 | |
| D. | 邻羟基苯甲酸的熔点比对羟基苯甲酸的熔点高 |
(2)在298K时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(3)298K时,反应2NO2(g)?N2O4(g);△H<0达到平衡后,根据下列图象判断引起平衡移动的因素及平衡移动的方向:

图(2)平衡将向正反应方向移动;图(3)引起平衡移动的因素是减小压强,图(4)引起平衡移动的因素是升高温度.
| A. | 氧化性:Cl2>Fe3+>I2 | B. | 氧化性:Fe3+>I2>Cl2 | ||
| C. | 还原性:I-<Fe2+<Cl- | D. | 还原性:Cl-<I-<Fe2+ |

