题目内容
1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是( )
| A、c(H+)>c(F-) |
| B、c(H+)>c(HF) |
| C、c(H+)>c(OH-) |
| D、c(HF)>c(F-) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:0.1mol/LHF溶液的pH=2,溶液中c(H+)<c(HF),说明HF是弱电解质,在水溶液里部分电离生成氢离子和氟离子,导致溶液呈酸性,但其电离程度较小.
解答:
解:0.1mol/LHF溶液的pH=2,溶液中c(H+)<c(HF),说明HF是弱电解质,在水溶液里部分电离生成氢离子和氟离子,导致溶液呈酸性,但其电离程度较小,
A.溶液呈存在电荷守恒,根据电荷守恒得c(H+)=c(F-)+c(OH-),所以c(H+)>c(F-),故A正确;
B.HF的电离程度较小,所以c(H+)<c(HF),故B错误;
C.溶液pH=2<7,溶液呈酸性,则c(H+)>c(OH-),故C正确;
D.HF为弱电解质,在水溶液中电离程度较小,所以c(HF)>c(F-),故D正确;
故选B.
A.溶液呈存在电荷守恒,根据电荷守恒得c(H+)=c(F-)+c(OH-),所以c(H+)>c(F-),故A正确;
B.HF的电离程度较小,所以c(H+)<c(HF),故B错误;
C.溶液pH=2<7,溶液呈酸性,则c(H+)>c(OH-),故C正确;
D.HF为弱电解质,在水溶液中电离程度较小,所以c(HF)>c(F-),故D正确;
故选B.
点评:本题考查了离子浓度大小比较,根据溶液pH与溶液浓度相对大小确定电解质强弱,再结合其电离程度确定溶液中离子浓度大小,题目难度不大.

练习册系列答案
相关题目
某花圃所种的花卉缺乏氮元素和钾元素,如果只施用一种化肥,则应施用的是( )
| A、K2CO3 |
| B、KNO3 |
| C、CO(NH2)2 |
| D、Ca(H2PO4)2 |
 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol?L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol?L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)3↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、M点时,溶液中沉淀的质量为3.9g |
| D、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
某种有机物完全燃烧只生成水和二氧化碳,对该有机物中的组成元素判断合理的是( )
| A、只有C、H两元素 |
| B、只有C、H、O三元素 |
| C、一定有C、H两元素,可能有氧元素 |
| D、不能确定任何元素 |
 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.
为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.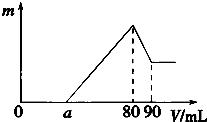 一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
一定质量的镁、铝混合物投到2mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入2mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: