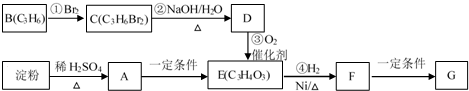
题目内容
X元素的气态氢化物的化学式为H2X,则X的最高正价氧化物的对应的水化物的化学式为( )
| A、H2XO3 |
| B、X(OH)2 |
| C、H3XO4 |
| D、H2XO4 |
考点:原子结构与元素的性质,根据化学式判断化合价
专题:原子组成与结构专题
分析:某元素R的气态氢化物的化学式为H2R,则R元素最低负化合价为-2,R为非金属元素,其最高正化合价为+6,据此分析.
解答:
元素R的气态氢化物的化学式为H2R,则R元素最低负化合价为-2,则其最高正化合价为+6,则该元素最高价氧化物对应的水化物的化学式为H2RO4,故D正确;
故选D.
故选D.
点评:本题考查了原子结构和元素性质,明确元素化合价与原子结构的关系是解本题关键,再结合元素化合价分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于下列装置说法正确的是( )


| A、装置①中,盐桥中的K+移向铜电极 |
| B、滴有酚酞溶液的装置②在电解过程中,b极先变红 |
| C、可以用装置③在铜上镀银,d极为铜 |
| D、装置④中发生铁的吸氧腐蚀 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化铝熔点高达2045℃,可用于制成坩埚熔化氢氧化钠固体 |
| B、合金大多具有良好的物理、化学或机械性能,可以用于制造货币中的硬币 |
| C、次氯酸具有还原性,可用于自来水的杀菌消毒 |
| D、钠的金属活泼性,钠可以从硫酸铜溶液中置换出金属铜 |
下列说法正确的是( )
| A、常温下,pH=7的硫酸铵和氨水混合溶液中:2c(NH4+)=c(SO42-) |
| B、常温下,0.1mol?L-1的硫酸氢钠、碳酸氢钠、碳酸钠溶液中,水电离出的c(OH-)依次增大 |
| C、在空气中蒸干硫酸铝溶液、硫酸亚铁溶液、氯化镁溶液可以得到对应的无水盐 |
| D、同温、同浓度的①氯化铵、②硫酸氢铵、③碳酸氢铵溶液中c(NH4+):①>③>② |
根据下表中的数据,结合学过的化学知识,判断下列说法正确的是( )
| 物质 | NaCl | MgCl2 | AlCl3 | SiCl4 |
| 沸点/℃ | 1465 | 1412 | 181(升华) | 57.6 |
| A、以上四种物质中,只有SiCl4是共价化合物 |
| B、若上述数据变化规律具有普遍性,则可预测:LiCl 的沸点大于BCl3的沸点 |
| C、因为AlCl3的沸点低,所以工业上可用电解熔融AlCl3制备Al |
| D、据上述数据,可判断NaCl、MgCl2为分子晶体 |
据报道,美国科学家制得一种新原子
X,它属于一种新元素,116号元素(元素符号暂用X代替),关于它的推测正确的是( )
283 116 |
| A、这种原子的中子数为167 |
| B、它位于元素周期表中第六周期 |
| C、这种元素一定是金属元素 |
| D、这种元素的原子易与氢化合 |