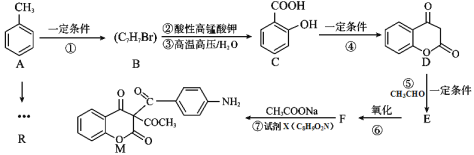
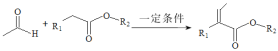
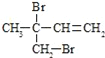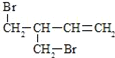题目内容
【题目】氮化硅(Si3N4)是一种重要的陶瓷材料,可用石英与焦炭在1400~1450℃的氮气气氛下合成:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
Si3N4(s)+6CO(g)﹣Q(Q>0),在反应条件下,向10L密闭容器中加入反应物,10min后达到平衡。完成下列填空:
(1)上述反应所涉及的元素,原子半径由大到小的顺序是______。其中一种元素的原子核外s电子数与p电子数相等,写出它的最外层电子排布的轨道表示式______。比较碳、硅两种元素的非金属性强弱,可以通过比较______(填:化合物性质的差异)来判断
(2)上述反应混合物中的极性分子是______,写出非极性分子的电子式______。从晶体类型的角度分析用氮化硅制造发动机中耐热部件的原因是______
(3)下列措施可以提高二氧化硅转化率的是______(选填编号)
a.增加二氧化硅用量b.升高反应温度
c.增大气体压强 d.向反应容器中多充入氮气
(4)下列描述中能说明反应已达平衡的是______(选填编号)
a.c(CO)=3c(N2)
b.v (CO)=3v(N2)
c.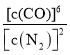 保持不变
保持不变
d.气体的压强保持不变
(5)测得平衡时固体质量减少了11.2g,则用氮气表示的平均反应速率为______
【答案】Si>C>N>O ![]() CH4与SiH4的稳定性或H2CO3与H2SiO3的酸性 CO
CH4与SiH4的稳定性或H2CO3与H2SiO3的酸性 CO ![]() 氮化硅是原子晶体、熔点高 bd cd 0.002mol/(L.min)
氮化硅是原子晶体、熔点高 bd cd 0.002mol/(L.min)
【解析】
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>C>N>O;
上述元素中的一种元素的原子核外s电子数与p电子数相等,核外电子数排布为1s22s22p4,根据泡利原理、洪特规则,最外层电子排布的轨道表示式为![]() ;
;
可以利用CH4与SiH4的稳定性或H2CO3与H2SiO3的酸性等,比较碳、硅两种元素的非金属性强弱;
(2)CO属于极性分子,氮气为非金属性分子,氮气分子中N原子之间形成3对共用电子对,电子式为![]() ,氮化硅是原子晶体、熔点高,可以制造发动机中耐热部件;
,氮化硅是原子晶体、熔点高,可以制造发动机中耐热部件;
(3)a.二氧化硅为固体,增加二氧化硅用量,平衡不移动,二氧化硅转化率减小,故a错误;
b.正反应为吸热反应,升高反应温度平衡正向移动,二氧化硅转化率增大,故b正确;
c.正反应为气体体积增大的反应,增大气体压强,平衡逆向移动,二氧化硅转化率减小,故c错误;
d.向反应容器中多充入氮气,平衡正向移动,二氧化硅转化率增大,故d正确,
故选:bd;
(4)a.平衡时CO、氮气的浓度之比不一定等于化学计量数之比,故a错误;
b.v (CO)=3v(N2),未指明正逆速率,若均为正反应速率,反应始终按该比例关系进行,但分别表示正逆速率时,反应到达平衡,故b错误;
c. 为浓度商,平衡正向移动该比值增大,平衡逆向移动该比值减小,温度不变平衡常数不变,所以该值不变说明到达平衡,故c正确;
为浓度商,平衡正向移动该比值增大,平衡逆向移动该比值减小,温度不变平衡常数不变,所以该值不变说明到达平衡,故c正确;
d.随反应进行气体物质的量增大,恒温恒容下压强增大,所以气体的压强保持不变时说明反应到达平衡,故d正确,
故选:cd;
(5)3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g) 根据方程式可知当反应2mol氮气时,固体质量减少(气体增加质量)为6×28-56=112g,所以固体质量减少了11.2g时,故参加反应氮气物质的量为0.2mol,则v(N2)= =0.002mol/(L·min)。
=0.002mol/(L·min)。

 阅读快车系列答案
阅读快车系列答案【题目】氮是一种重要的元素,可用来合成NH3与 HNO3等一系列重要化工产品。
(1)在标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.9g/mL,则该氨水的物质的量浓度是_______(小数点后保留一位)。
(2)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的。其主要反应是:
①2C + O2 → 2CO ②C + H2O(g) → CO + H2 ③CO + H2O(g) → CO2 + H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:
气体 | CO | N2 | CO2 | H2 | O2 |
体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
则计算参加反应的H2O(g)和氧气的体积比V(H2O)/V(氧气)=__________上表中x=________m3,实际消耗了___________ kg焦炭。
(3)工业生产硝酸时尾气必须充分处理以避免环境污染,常用NaOH溶液吸收,吸收时发生反应:
①2NO2 + 2NaOH→NaNO3 + NaNO2 + H2O
②NO + NO2 + 2NaOH→2NaNO2 + H2O
现将22.4升(标准状况)NOx(只含NO、NO2,忽略其它成分)气体缓缓通入足量NaOH溶液中,充分反应,气体全部被吸收。则反应中产生NaNO3和NaNO2各多少克?(用含x的代数式表示)____________________