题目内容
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料。工业上提取铝的工艺流程如下:
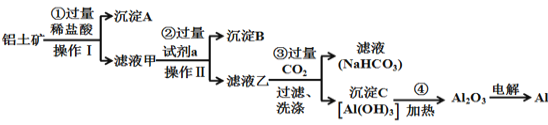
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是:___________________;
(2)沉淀A的化学式是__________;
(3)步骤③中通入过量CO2,产生沉淀C的离子方程式为_________________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为____________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂,下列氧化物中不能与铝粉组成铝热剂的是___________;
a. MgO b. V2O5 c. Fe3O4 d. MnO2
(6)我国首创以铝—空气—海水电池为能源的新型电池,用作海水标志灯已研制成功。该电池以取之不尽的海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。负极材料是铝,正极材料可以用石墨。写出正极电极反应式___________。
【答案】增大固液接触面积,加快反应速率,增大原料的浸取率 SiO2 AlO2+CO2+2H2O=Al(OH)3↓+ HCO3 2Al2O3(熔融)![]() 4Al+3O2↑ a 2H2O +O2+4 e=4OH
4Al+3O2↑ a 2H2O +O2+4 e=4OH
【解析】
铝土矿中加入过量试剂a,然后操作I得到沉淀A和滤液甲,则操作I为过滤,滤液甲中加入过量NaOH溶液操作II后得到沉淀B和滤液乙,操作II是过滤;Al2O3、SiO2能溶于强碱溶液而Fe2O3不溶于强碱溶液,SiO2不溶于稀盐酸而Fe2O3、Al2O3能溶于稀盐酸,根据图知,滤液甲中含有铝元素,则试剂a为稀盐酸,沉淀A为SiO2,滤液甲中溶质为氯化铝和氯化铁、HCl,沉淀B为Fe(OH)3,滤液乙中含有NaAlO2和NaOH、NaCl,向滤液乙中通入过滤二氧化碳得到滤液碳酸氢钠溶液,沉淀C为Al(OH)3,加热氢氧化铝得到氧化铝。
(1)在操作Ⅰ之前先将铝土矿研磨成粉末,目的是增大固液接触面积,加快反应速率,增大原料的浸取率;
(2)通过以上分析知,沉淀A为SiO2,故答案为:SiO2;
(3)步骤③中通入过量CO2气体生成的氢氧化铝,离子方程式为:AlO2+CO2+2H2O=Al(OH)3↓+ HCO3;
(4) 工业上用电解熔融Al2O3的方法制备金属铝,其反应方程式为: 2Al2O3(熔融)![]() 4Al+3O2↑;
4Al+3O2↑;
(5)铝热反应是铝粉把某些金属氧化物当中的金属置换出来的反应,该反应将会放出大量的热,其中铝粉和金属氧化物作为铝热剂,镁条和氯酸钾作为引燃剂,作为铝热剂的金属氧化物有:氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬、二氧化锰等,题目要求选择不能作铝热剂的,故选a;
(6)题干已经指明,该电池的电极总反应是Al与O2的反应。反应中Al失电子,应为原电池的负极;O2得电子,应为原电池的正极,正极电极反应式为:2H2O +O2+4 e=4OH。