题目内容
11.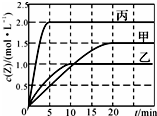 向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( )
向甲、乙、丙三个容积固定不变的密闭容器中充入一定量的X和Y,一定条件下发生反应 X(g)+aY(g)?2Z(g).各容器的反应温度、反应物起始量、反应过程中Z的浓度随时间变化分别以如图和下表来表示.下列说法不正确的是( ) | 容器 | 甲 | 乙 | 丙 | |
| 容积/L | 0.5 | 0.5 | 1.0 | |
| 温度/℃ | T1 | T2 | T2 | |
| 反应物起始量 | 1.0 mol X 0.5 mol Y | 1.0 mol X 0.5 mol Y | 4.0 mol X 2.0 mol Y |
| A. | 该反应温度升高,平衡常数减小 | |
| B. | 20 min内甲容器中反应的平均速率:v(X)=0.0375mol•(L•min)-1 | |
| C. | 10 min时,其他条件不变,向乙容器中再加入2 mol Z,平衡向逆反应方向移动 | |
| D. | 其他条件不变,若缩小乙的体积,Y的转化率增大 |
分析 A.比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高Z的浓度越低,升高温度平衡向逆反应移动,正反应是放热反应;
B.由图可知,20min内甲容器中Z的浓度变化量为1.5mol/L,根据v=$\frac{△c}{△t}$,计算v(Z),再利用速率之比等于化学计量数之比计算v(X);
C.加入生成物,生成物浓度增大,平衡向着逆向移动;
D.根据表中乙、丙的数据,丙的体积是乙的2倍,物质的量是乙的4倍,也就是起始浓度是乙的2倍,但发现平衡时丙的浓度仍然是乙的2倍,也就是该反应是一个气体体积不变的反应,所以a=1.
解答 解:A.比较甲与乙可知,乙先到达平衡,故温度T1<T2,温度越高Z的浓度越低,升高温度平衡向逆反应移动,正反应是放热反应,所以温度升高,平衡常数减小,故A正确;
B、由图可知,20min内甲容器中Z的浓度变化量为1.5mol/L,计算v(Z)=$\frac{1.5mol/L}{20min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(X)=$\frac{1}{2}$v(Z)=$\frac{1}{2}$×0.075mol/(L•min)=0.0375mol/(L•min),故B正确;
C.其他条件不变,向乙容器中再加入2 mol Z,生成物浓度增大,平衡向逆反应方向移动,故C正确;
D.根据表中乙、丙的数据,丙的体积是乙的2倍,物质的量是乙的4倍,也就是起始浓度是乙的2倍,但平衡时丙的浓度仍然是乙的2倍,也就是该反应是一个气体体积不变的反应,则a=1,反应前后计量数相等,所以若缩小乙的体积,平衡不移动,则Y的转化率不变,故D错误;
故选D.
点评 本题考查化学平衡移动、计算及化学平衡图象,题目难度中等,注意理解图象的纵坐标和横坐标的意义,明确化学平衡及其影响因素为解答关键,试题培养了学生的灵活应用能力.

| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
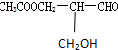 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)实验室检验Y元素的气态氢化物的方法和现象是用湿润的红色石蕊试纸检验,试纸变蓝;
(3)Z元素与氢元素、氧元素形成的化合物HZO有漂白性,其结构式为H-O-Cl;
(4)探寻物质的性质差异性是学习的重要方法之一.T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是H2CO3(填分子式),理由是H2CO3是弱酸,其余均为强酸;
(5)将T元素的氧化物TO2和Z的单质同时通入水中,可发生反应,该反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4.
| A. | 若m>n,金属性W>X | |
| B. | 若m>n,气态氢化物的稳定性HmY>HnZ | |
| C. | 若m<n,氧化性Xn+>Wm+ | |
| D. | 若m<n,原子序数a>b>c>d |
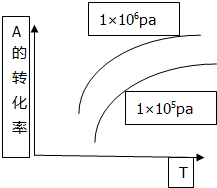 反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )
反应mA(g)+B(s)?pC(g)+qD(g)△H>0中A的转化率和温度(T)、压强(P)的关系如图曲线,下列结论正确的是( )| A. | 逆反应为放热反应m<p+q | B. | 逆反应为吸热反应m>p+q | ||
| C. | 正反应为放热反应m<p+q | D. | 正反应为吸热反应m>p+q |
| A. | 有机物中都存在同分异构现象 | |
| B. | 14C和14Si是同位素 | |
| C. | C2H5Cl没有同分异构体 | |
| D. | 只要含有的官能团种类相同就是同系物 |