题目内容
一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,2CH3OH+3O2+4OH-
2CO32-+6H2O,则下列说法正确的是( )
| 放电 |
| 充电 |
| A、构成该电池的正极和负极必须是两种活性不同的金属 |
| B、充电时有CH3OH生成的电极为阳极 |
| C、放电时溶液中的OH-移向正极 |
| D、放电时负极的电极反应为:CH3OH-6e-+8OH-═CO32-+6H2O |
考点:化学电源新型电池
专题:电化学专题
分析:放电时,该装置是原电池,负极上电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,放电时,电解质溶液中阴离子向负极移动,充电时,阴阳极上电极反应式与负极、正极上电极反应式相反,据此分析解答.
解答:
解:A.构成该电池的正负极可能是导电的非金属,如石墨,故A错误;
B.充电时,阴极上CO32-得电子生成CH3OH,故B错误;
C.放电时,电解质溶液中OH-向负极移动,故C错误;
D.放电时,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,故D正确;
故选D.
B.充电时,阴极上CO32-得电子生成CH3OH,故B错误;
C.放电时,电解质溶液中OH-向负极移动,故C错误;
D.放电时,负极上甲醇失电子发生氧化反应,电极反应式为CH3OH-6e-+8OH-═CO32-+6H2O,故D正确;
故选D.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的电极反应是解本题关键,结合离子的移动方向分析解答,难点是电极反应式的书写,要结合电解质溶液的酸碱性书写.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
如图为两个原电池装置图,由此判断下列说法错误的是( )


| A、当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B、两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C、由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D、由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1mol/L的NaOH溶液中Na+的物质的量为1mol |
| B、28g乙烯所含共用电子对数目为4NA |
| C、常温常压下,32g O2与O3的混合气体中含有的原子总数为2NA |
| D、1mol苯中含有碳碳双键的数目为3NA |
短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列说法不正确的是( )
| A、X是钠元素 |
| B、离子半径X+>Z2- |
| C、同族元素中Z的氢化物稳定性最强 |
| D、同周期元素中Y的非金属性最强 |
解释下列事实的方程式正确的是( )
| A、用碳酸钠溶液处理水垢中的硫酸钙:Ca2++CO32-=CaCO3↓ | ||||
| B、SO2使紫色石蕊溶液变红色:SO2+H2O=2H++SO32- | ||||
| C、用石墨电极电解AlCl3溶液,阴极附近生成沉淀:2Al3++6H2O+6e-=2Al(OH)3↓+3H2↑ | ||||
D、工业上制取硅:SiO2+C
|
如图所示的装置能够组成原电池产生电流的是( )
A、 稀硫酸钠 |
B、 NaCl溶液 |
C、 |
D、 酒精 |
 已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,E与F同周期,且F原子核内的质子数是D原子核外电子数的2倍.据此请回答:
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,E与F同周期,且F原子核内的质子数是D原子核外电子数的2倍.据此请回答: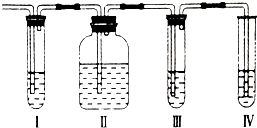 在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题:
在实验室里制取的乙烯中常混有少量的二氧化硫,某化学兴趣小组设计了如图所示的实验装置以确认上述混合气体中是否含有SO2和C2H4.请回答下列问题: