题目内容
3.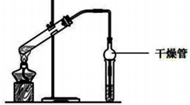 (1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
(1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.①与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是防止发生倒吸.
②己知表格数据:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
(2)按正确操作重新实验,该学生很快在小试管中收集到了乙_酸乙酯、乙酸、乙醇的混合物.现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,图是分离操作步骤流程图.在图中圆括号表示加入适当的试剂,编号表示适当的分离方法.
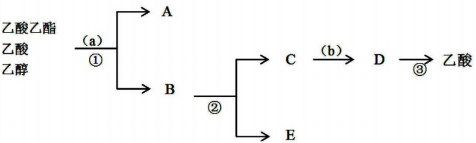
①写出加入的试剂名称:试剂(a)是饱和碳酸钠溶液;试剂(b)是稀硫酸溶液.
②写出有关的操作分离方法:①是分液,②是蒸馏,③是蒸馏.
分析 (1)①混合气体中含有乙醇和乙酸易溶于水已发生倒吸.球形干燥管;
③依据表中数据可知乙醇沸点低易挥发损坏;
(2)分离物质的原则:所加试剂不与所分离的药品反应,不引入新杂质,分离后的药品容易与被分离的药品分开.加入饱和碳酸钠a溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来.
解答 解:(1)①混合气体中含有乙醇和乙酸易溶于水,容易发生倒吸.球形干燥管能够防止发生倒吸,故答案为:防止发生倒吸;
③依据表中数据可知乙醇沸点低易挥发损坏,所以应过量一些,故答案为:乙醇的沸点低,易挥发而损耗;
(2)加入饱和碳酸钠溶液a,溶解乙醇和乙酸反应生成醋酸钠溶液,乙酸乙酯在碳酸钠溶液中不溶分层分液后将乙酸乙酯分离出来,蒸馏混合溶液分离出乙醇,然后向剩余混合液中加入稀硫酸b,稀硫酸与醋酸钠反应生成醋酸和硫酸钠混合溶液,蒸馏将醋酸分离出来,
故答案为:①饱和碳酸钠溶液;稀硫酸溶液;②分液,蒸馏,蒸馏.
点评 本题考查了实验室制备乙酸乙酯,解题时注意饱和碳酸钠溶液的作用,实验装置的设计,乙醇、乙酸、乙酸乙酯的性质.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
17.在甲、乙两烧杯中,分别含有下列离子Cu2+、K+、H+、Cl-、CO32-、OH-中的三种离子.已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
| A. | Cu2+、H+、Cl- | B. | CO32-、OH-、Cl- | C. | K+、H+、Cl- | D. | K+、CO32-、OH- |
14.常温下,下列各组溶液中的离子一定能大量共存的是( )
| A. | 酚酞呈无色的溶液中:K+、Al3+、Cl-、HCO3- | |
| B. | 使pH试纸变深蓝色的溶液中:ClO-、Na+、AlO2-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、I-、Fe2+、SO42- | |
| D. | 加入铝粉产生氢气的溶液:Na+、SO42-、Mg2+、NO3- |
15.由两种有机物组成的混合物,在一定的温度和压强下完全气化为气体,在相同的温度和压强下,只要混合气体体积一定,那么无论混合物以何种比例混合,它在完全燃烧时所消耗的氧气体积也是一定的,符合这种情况的可能是( )
| A. | 乙醇(C2H6O)和乙酸(C2H4O2) | B. | 乙醛(C2H4O)和甲醇(CH4O) | ||
| C. | 丙醛(C3H6O)和甘油(C3H8O3) | D. | 丙酮(C3H6O)和丙二醇(C3H8O2) |
12.根据CH2═CH-CH2COOH的结构,它不可能具有的性质是( )
| A. | 与新制氢氧化铜反应 | |
| B. | 使溴的四氯化碳溶液褪色 | |
| C. | 与乙醇在浓硫酸催化下发生酯化反应 | |
| D. | 与银氨溶液反应析出银 |