题目内容
现有NaHCO3和Na2CO3?xH2O的混合物7.4g,加热到反应完全,并让产生的气体依次被无水氯化钙B和碱石灰C完全吸收,冷却至室温时,测得B管增重3.78g,C管增重0.44g,请求算下列问题:
(1)残留固体的成分是 ,质量是 g.
(2)原混合物中NaHCO3的质量是 g.
(3)求出x的值(要求有计算过程)
(1)残留固体的成分是
(2)原混合物中NaHCO3的质量是
(3)求出x的值(要求有计算过程)
考点:化学方程式的有关计算
专题:计算题
分析:(1)加热发生反应:2NaHCO3
Na2CO3 +CO2↑+H2O、Na2CO3?xH2O
Na2CO3 +xH2O,测得B管增重3.78克为生成的水的质量,C管增重0.44克为生成的CO2的质量,残留固体为碳酸钠,根据质量守恒计算残留固体质量;
(2)碳酸氢钠加热分解生成二氧化碳,根据二氧化碳的质量结合方程式计算碳酸氢钠的质量;
(3)根据根据二氧化碳的质量结合方程式计算碳酸氢钠分解生成水的质量,进而计算碳酸钠晶体分解生成水的质量,再计算碳酸钠晶体的质量,根据方程式计算x的值.
| ||
| ||
(2)碳酸氢钠加热分解生成二氧化碳,根据二氧化碳的质量结合方程式计算碳酸氢钠的质量;
(3)根据根据二氧化碳的质量结合方程式计算碳酸氢钠分解生成水的质量,进而计算碳酸钠晶体分解生成水的质量,再计算碳酸钠晶体的质量,根据方程式计算x的值.
解答:
解:(1)加热发生反应:2NaHCO3
Na2CO3 +CO2↑+H2O、Na2CO3?xH2O
Na2CO3 +xH2O,测得B管增重3.78克为生成的水的质量,C管增重0.44克为生成的CO2的质量,残留固体为碳酸钠,根据质量守恒,残留固体质量=7.4g-3.78g-0.44g=3.18g,
故答案为:Na2CO3;3.18;
(2)碳酸氢钠加热分解生成二氧化碳为0.44g,则:
2NaHCO3
Na2CO3 +CO2↑+H2O
168 44
m(NaHCO3) 0.44g
所以m(NaHCO3)=
=1.68g
故答案为:1.68;
(3)2NaHCO3
Na2CO3 +CO2↑+H2O
44 18
0.44g 0.18g
故碳酸钠晶体加热分解生成水的质量=3.78g-0.18g=3.6g,碳酸钠晶体的质量=7.4g-1.68g=5.72g,
Na2CO3?xH2O
Na2CO3 +xH2O
(106+18x) 18x
5.72g 3.6g
所以(106+18x):18x=5.72g:3.6g
解得x=10
答:x的值是10.
| ||
| ||
故答案为:Na2CO3;3.18;
(2)碳酸氢钠加热分解生成二氧化碳为0.44g,则:
2NaHCO3
| ||
168 44
m(NaHCO3) 0.44g
所以m(NaHCO3)=
| 0.44g×168 |
| 44 |
故答案为:1.68;
(3)2NaHCO3
| ||
44 18
0.44g 0.18g
故碳酸钠晶体加热分解生成水的质量=3.78g-0.18g=3.6g,碳酸钠晶体的质量=7.4g-1.68g=5.72g,
Na2CO3?xH2O
| ||
(106+18x) 18x
5.72g 3.6g
所以(106+18x):18x=5.72g:3.6g
解得x=10
答:x的值是10.
点评:本题考查混合物计算、化学方程式有关计算,明确发生的反应是解题关键,综合考查学生分析问题、处理数据的能力,难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、H2SO4的摩尔质量为98g |
| B、标准状况下22.4L H2所含分子数约为6.02×1023 |
| C、1mol H2SO4的质量是98g/mol |
| D、80g NaOH溶于2L水,形成溶液的浓度为1mol/L |
下列说法中,正确的是( )
| A、高温时纯碱和石英发生反应Na2CO3+SiO2═Na2SiO3+CO2↑,所以硅酸酸性比碳酸酸性强 |
| B、硅胶可用作干燥剂、吸附剂、催化剂载体 |
| C、石英坩埚、光导纤维、太阳能电池都是二氧化硅的用途 |
| D、自然界中存在储量丰富的单质硅 |
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物总能量一定低于反应物总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
下列各组实验现象可用同一原理解释的是( )
| A、品红溶液中分别通入SO2和Cl2,品红均褪色 |
| B、浓硫酸和浓盐酸长期暴露在空气中浓度都会降低 |
| C、溴水分别滴入植物油和裂化汽油中,溴水均褪色 |
| D、鸡蛋白溶液中分别加入NaCl溶液和CuCl2溶液,均有固体析出 |

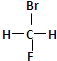 和
和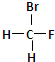 ②1H-、2H、3H+、D2 ③淀粉和纤维素 ④
②1H-、2H、3H+、D2 ③淀粉和纤维素 ④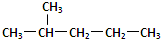 和
和 ⑤16O2、18O3 ⑥235U、238U
⑤16O2、18O3 ⑥235U、238U