题目内容
如图是化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
CH3CH2OH+NaBr+H2SO4
CH3CH2Br+NaHSO4+H2O,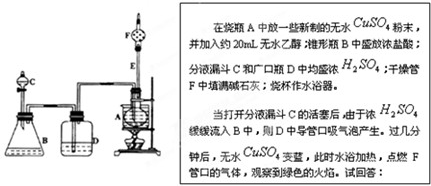
(1)B中逸出的主要气体是 (填名称);
(2)D瓶的作用是 ;
(3)E管的作用是 ;
(4)F管口点燃的气体是 (填化学式);
(5)A瓶中无水CuSO4变蓝的原因是 .
(6)由A中发生的反应事实可推断出的结论是: .
CH3CH2OH+NaBr+H2SO4
| △ |

(1)B中逸出的主要气体是
(2)D瓶的作用是
(3)E管的作用是
(4)F管口点燃的气体是
(5)A瓶中无水CuSO4变蓝的原因是
(6)由A中发生的反应事实可推断出的结论是:
考点:性质实验方案的设计
专题:实验设计题
分析:将C中浓H2SO4滴入B中浓盐酸中,由于浓H2SO4有吸水性,且溶于水要放出大量的热,故B中逸出HCl(g),经D中浓H2SO4干燥,进入A中,HCl溶于C2H5OH中,二者发生反应:C2H5OH+HCl
C2H5Cl+H2O,CuSO4吸收水分变为蓝矾,促使上列反应向右进行,加热时,生成的C2H5Cl从F处逸出,点燃火焰呈绿色,以此解答该题.
| △ |
解答:
解:(1)浓盐酸在浓硫酸作用下,由于浓H2SO4有吸水性,且溶于水要放出大量的热,可促使盐酸的挥发,生成氯化氢气体,
故答案为:氯化氢;
(2)D中为浓硫酸,进入D中的气体为氯化氢,浓硫酸可起到干燥的作用,
故答案为:干燥HCl;
(3)E导管较长,可起到冷凝回流的作用,
故答案为:冷凝乙醇蒸气;
(4)点燃火焰呈绿色,说明F出燃烧的气体为CH3CH2Cl,
故答案为:CH3CH2Cl;
(5)A瓶中无水变蓝,说明有水生成,氯化氢与乙醇发生取代反应生成水,
故答案为:乙醇与HCl反应生成的水被无水硫酸铜吸收后生成了胆矾;
(6)由A中发生的反应事实,可说明生成水和CH3CH2Cl,证明醇分子中的羟基可被氯化氢分子中的氯原子取代,
故答案为:醇分子中的羟基可被氯化氢分子中的氯原子取代.
故答案为:氯化氢;
(2)D中为浓硫酸,进入D中的气体为氯化氢,浓硫酸可起到干燥的作用,
故答案为:干燥HCl;
(3)E导管较长,可起到冷凝回流的作用,
故答案为:冷凝乙醇蒸气;
(4)点燃火焰呈绿色,说明F出燃烧的气体为CH3CH2Cl,
故答案为:CH3CH2Cl;
(5)A瓶中无水变蓝,说明有水生成,氯化氢与乙醇发生取代反应生成水,
故答案为:乙醇与HCl反应生成的水被无水硫酸铜吸收后生成了胆矾;
(6)由A中发生的反应事实,可说明生成水和CH3CH2Cl,证明醇分子中的羟基可被氯化氢分子中的氯原子取代,
故答案为:醇分子中的羟基可被氯化氢分子中的氯原子取代.
点评:本题考查物质的性质实验,为高考常见题型和高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作注意事项,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式正确的是( )
| A、等体积、等浓度的Ba(OH)2溶液与KAl(SO4)2溶液混合:3Ba2++6OH-+2 Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、向NaOH溶液中加入金属铝:Al+2OH-═AlO2-+2H2O |
在一定条件下,钠与O2反应可生成1.5g固体,若将相同质量的钠与80mL 0.50mol/L的盐酸反应,钠恰好完全转化生成NaCl,则1.5g固体的成分是( )
| A、Na2O |
| B、Na2O2 |
| C、Na2O和Na2O2 |
| D、Na2O2和NaO2 |

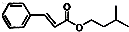 )的路线如下:
)的路线如下: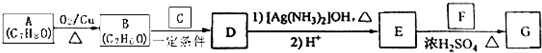
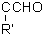 +H2O.
+H2O.