题目内容
6.A、B、D、E、G原子序数依次增大的五种短周期元素,在所有短周期元素中,A的原子半径与G的原子半径之比最小,B、D、E三种元素的原子的电子层数相同,B元素形成的某种单质可做饰品,E与A、B、D、G均能形成多种常见化合物.(1)G2E2的电子式是
 .
.(2)实验室制取B2A2的化学方程式是CaC2+2H2O→Ca(OH)2+HC≡CH↑.
(3)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比为l:l,仅用一个化学方程式表示甲既有氧化性又有还原性2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
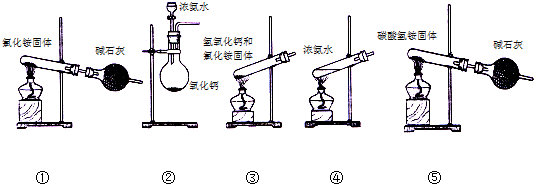
(4)电解质乙和丙由上述元素中的几种组成,l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则丙中的化学键类型有离子键、极性键,乙易分解生成一种具有碱性的物质,下列可制备该物质的方法有②④⑤(填序号).
(5)化合物丁由A、B两元素形成的含18个电子的物质,丁与氧气、KOH溶液可构成燃料电池,写出该燃料电池负极电极反应式C2H6+18OH--14e-=2CO32-+12H2O.
(6)化合物戊是由A、B、E三种元素按原子个数比为1:1:2组成的一种酸,戊在常温下为固体.已知在含1mol 戊的水溶液中加入1mol Na2CO3恰好反应生成正盐.则戊的化学式是H2C2O4.某学习小组用下图所示装置(夹持仪器已略)检验戊与浓硫酸混合加热发生分解反应的产物.
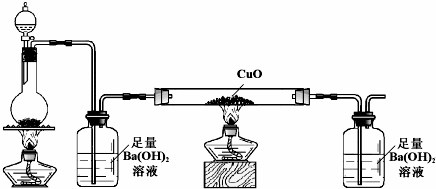
实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色.写出戊分解反应的化学方程式:HOOC-COOH$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O.
分析 A、B、D、E、G原子序数依次增大的五种短周期元素,A的原子半径与G的原子半径之比最小,则A为H元素;B、D、E三种元素原子的电子层数相同,B元素形成的某种单质可做饰品,则B为C,形成的单质为金刚石,E与A、B、D、G均能形成多种常见化合物,则E为O,所以D为N;G与氧形成氧化钠、过氧化钠,所以G为Na,
(1)Na2O2是钠离子和过氧根离子构成的离子化合物;
(2)B2A2为C2H2,实验室利用碳化钙与水反应制备乙炔;
(3)甲为过氧化氢,分解时既有氧化性又有还原性;
(4)l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则乙为NH3•H2O,丙为NaOH,NaOH中含有离子键,极性共价健,制备氨气,可用加入浓氨水,浓氨水与氧化钙以及氯化铵和氢氧化钙的方法制备,加热固体时,试管口应略向下倾斜;
(5)A、B两元素形成的含18个电子的气态化合物为C2H6,在碱性电池中为负极,发生氧化反应;
(6)化合物戊是由A、B、E三种元素按原子个数比为1:1:2组成的一种酸,戊在常温下为固体.已知在含1mol 戊的水溶液中加入1mol Na2CO3恰好反应生成正盐,应为H2C2O4,为二元酸,实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色.说明有CO和生成CO2.
解答 解:A、B、D、E、G原子序数依次增大的五种短周期元素,A的原子半径与G的原子半径之比最小,则A为H元素;B、D、E三种元素原子的电子层数相同,B元素形成的某种单质可做饰品,则B为C,形成的单质为金刚石,E与A、B、D、G均能形成多种常见化合物,则E为O,所以D为N;G与氧形成氧化钠、过氧化钠,所以G为Na,
(1)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
(2)B2A2为C2H2,实验室利用碳化钙与水反应制备乙炔,反应为CaC2+2H2O→Ca(OH)2+HC≡CH↑,
故答案为:CaC2+2H2O→Ca(OH)2+HC≡CH↑;
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,则甲为过氧化氢,分解时既有氧化性又有还原性,该反应为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(4)l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则乙为NH3•H2O,丙为NaOH,NaOH中含有离子键,极性共价健,制备氨气,可用加入浓氨水,浓氨水与氧化钙以及氯化铵和氢氧化钙的方法制备,加热固体时,试管口应略向下倾斜,只有②④⑤正确,
故答案为:离子键、极性键; ②④⑤;
(5)A、B两元素形成的含18个电子的气态化合物为C2H6,在碱性电池中为负极,负极反应为C2H6-14e-+180H-=2CO32-+12H2O,
故答案为:C2H6+18OH--14e-=2CO32-+12H2O;
(6)化合物戊是由A、B、E三种元素按原子个数比为1:1:2组成的一种酸,戊在常温下为固体.已知在含1mol 戊的水溶液中加入1mol Na2CO3恰好反应生成正盐,应为H2C2O4,为二元酸,实验时两个广口瓶中均产生白色沉淀;玻璃管中固体变为红色.说明有CO和生成CO2,反应的方程式为HOOC-COOH$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O,
故答案为:H2C2O4;HOOC-COOH$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O.
点评 本题综合考查无机物的推断、物质的性质实验设计等知识,侧重于学生的分析、实验能力的考查,涉及位置、结构、性质的综合应用,难度较大,综合性较强,元素的推断是解答的关键,并熟悉氧化还原反应、化学键、原电池及化学用语等知识点来解答.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | |||||
| 其他 | 阳离子 核外无电子 | 无机非金属材料的主角 | 焰色反 应呈黄色 |
(2)R 元素的单质与水反应的离子方程式是Cl2+H2O═H++Cl-+HClO.
(3)Z 与 Q 相比,金属性较强的是Na(用元素符号表示),下列事实能证明这一 结论的是bc(填字母序号).
a.Q 的熔点比 Z 的熔点高,Q 的硬度比 Z 的硬度大
b.Z 与冷水反应迅速,而 Q 与冷水几乎不反应
c.Z 的最高价氧化物对应水化物是强碱,而 Q 的最高价氧化物对应水化物具有两性
(4)与 Y 元素同主族的短周期元素 E 在自然界中存在多种核素,它们之间的关系互为同位素,其中用于测定一些文物年代的核素的符号为146C(或14C).
(5)写 出 Z2M2与 X2M 反 应 的 化 学 方 程 式 并 标 出 电 子 转 移 关 系
 .
. | 实验序号 | 实验内容 | 实验结果 |
| a | 加AgNO3溶液 | 有白色沉淀生成 |
| b | 加足量NaOH溶液并加热 | 收集到气体1.12L(已折算成标准 状况下的体积) |
| c | 加足量BaC12溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g,第二次 称量读数为2.33g |
(1)该混合物中一定不存在的离子是Mg2+、Cu2+、Ba2+ .
(2)试写出实验b发生反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(3)溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol•L-1) |
(5)Ba2+是一种重金属离子,某环境监测小组欲利用Na2S2O3、KI、K2Cr2O7等试剂测定某工厂废水中Ba2+的浓度.取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液反应,反应液中再滴加0.100mol•L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL.已知有关的离子方程式为:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;
②I2+2S2O32-=2I-+S4O62-.
试计算该工厂废水中Ba2+的物质的量浓度0.024mol•L-1.(写出具体计算过程)
| A. | 会形成酸雨 | B. | 漂白性 | C. | 还原性 | D. | 无色无味 |
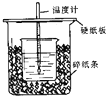 50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.
50mL0.50mol/L 盐酸与50mL0.55mol/LNaOH 溶液在如图所示的装置中进行中和反应.