题目内容
16.CO2的摩尔质量为44g/mol;88g CO2的物质的量为2mol,在标准状况下的体积约为44.8L.分析 摩尔质量以g/mol为单位,数值上等于其相对分子质量,根据n=$\frac{m}{M}$计算CO2的物质的量,根据V=nVm计算其体积.
解答 解:CO2的摩尔质量为44g/mol,88g CO2的物质的量为$\frac{88g}{44g/mol}$=2mol,在标准状况下的体积约为2mol×22.4L/mol=44.8L,
故答案为:44g/mol;2mol;44.8L.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
7.选择合适的药品,把下列物质中含有的少量杂质(括号内为杂质)除去,写出所需的药品和有关的离子方程式.
| 物质(杂质) | 除杂药品 | 离子方程式 |
| NaHCO3溶液(Na2CO3) | ||
| CO2(HCl) | ||
| FeCl2溶液(FeCl3) | ||
| FeCl3溶液(FeCl2) |
4.AlON(氮氧化铝)是一种透明高硬度防弹材料,可以由反应Al2O3+C+N2═2AlON+CO(高温)合成,下列有关说法不正确的是( )
| A. | 氮氧化铝中氮的化合价是-1价 | |
| B. | 反应中氮气作氧化剂,碳做还原剂 | |
| C. | 反应中每生成5.7g AlON 同时生成1.12 L CO | |
| D. | 反应中氧化产物和还原产物的物质的量之比是1:2 |
11.常温下,下列各组离子一定可以大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-4的溶液中:Na+、SiO32-、SO32-、K+ | |
| B. | 加入Al能放出H2的溶液中:Cl-、Mg2+、NO3-、K+ | |
| C. | 由水电离出的c(OH-)=10-13mol•L-1的溶液中:ClO-、Na+、SO32-、Cl- | |
| D. | pH=1的溶液中:Mg2+、Br-、K+、AlO2- |
 甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol,
甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物.工业上可用CO和H2制取甲醇,化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=b kJ/mol, .
.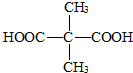 .
.
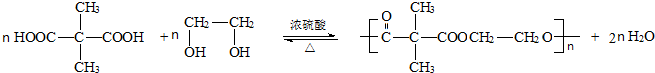 反应类型:缩聚反应.
反应类型:缩聚反应.