题目内容
如表为元素周期表的一部分,请按要求完成下列问题:

(1)b的原子结构示意图为:
(2)m元素在周期表中的位置是 ,第6周期共有元素 种.
(3)表中所给元素形成的化合物分子含有四核18电子,其分子式为
(4)i、j、k元素最高价氧化物对应水化物的酸性强弱为.
(5)d、e、f、g四种元素的离子半径大小为 (用离子符号表示).
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,请你写出它们发生反应的离子方程式 .
(7)C和j形成的一种化合物的相对分子质量在170-190之间,且c的质量分数约为30%,则这种化合物的分子式为 .
(8)有人曾把a元素编排在ⅦA族e元素上方,请你利用相关知识予以解释 .

(1)b的原子结构示意图为:
(2)m元素在周期表中的位置是
(3)表中所给元素形成的化合物分子含有四核18电子,其分子式为
(4)i、j、k元素最高价氧化物对应水化物的酸性强弱为.
(5)d、e、f、g四种元素的离子半径大小为
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,请你写出它们发生反应的离子方程式
(7)C和j形成的一种化合物的相对分子质量在170-190之间,且c的质量分数约为30%,则这种化合物的分子式为
(8)有人曾把a元素编排在ⅦA族e元素上方,请你利用相关知识予以解释
考点:元素周期律和元素周期表的综合应用
专题:
分析:由元素在周期表中位置,可知a为H,b为C、c为N、d为O、e为F、f为Na、g为Mg、h为Al、i为Si、j为S、k为Cl、m为Fe.
(1)b为C,原子核外有2个电子层,各层电子数为2、4;
(2)由m在周期表位置可知其位于第四周期第Ⅷ族,第六周期容纳32种元素;
(3)给元素形成的化合物分子含有四核18电子为H2O2;
(4)非金属性越强,元素最高价含氧酸的酸性越强;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,该元素为Al,应是铝离子与偏铝酸根铝离子,二者发生水解反应生成氢氧化铝沉淀;
(7)根据氮元素质量分数计算硫元素质量分数,进而计算分子中N、S原子数目之比,结合相对分子质量计算确定分子式;
(8)a元素的原子的获得一个电子即可达到稳定结构.
(1)b为C,原子核外有2个电子层,各层电子数为2、4;
(2)由m在周期表位置可知其位于第四周期第Ⅷ族,第六周期容纳32种元素;
(3)给元素形成的化合物分子含有四核18电子为H2O2;
(4)非金属性越强,元素最高价含氧酸的酸性越强;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,该元素为Al,应是铝离子与偏铝酸根铝离子,二者发生水解反应生成氢氧化铝沉淀;
(7)根据氮元素质量分数计算硫元素质量分数,进而计算分子中N、S原子数目之比,结合相对分子质量计算确定分子式;
(8)a元素的原子的获得一个电子即可达到稳定结构.
解答:
解:由元素在周期表中位置,可知a为H,b为C、c为N、d为O、e为F、f为Na、g为Mg、h为Al、i为Si、j为S、k为Cl、m为Fe.
(1)b为C,原子核外有2个电子层,各层电子数为2、4,其原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)由m在周期表位置可知其位于第四周期第Ⅷ族,第六周期容纳32种元素,故答案为:第四周期第Ⅷ族;32;
(3)给元素形成的化合物分子含有四核18电子为H2O2,故答案为:H2O2;
(4)非金属性Si<S<Cl,非金属性越强,元素最高价含氧酸的酸性越强,故酸性:H2SiO3<H2SO4<HClO4,故答案为:H2SiO3<H2SO4<HClO4;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:O2->F->Na+>Mg2+,故答案为:O2->F->Na+>Mg2+;
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,该元素为Al,应是铝离子与偏铝酸根铝离子,二者发生水解反应生成氢氧化铝沉淀,反应离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3 ↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3 ↓;
(7)c为N元素,j为S元素,形成的化合物中N的质量分数为30%,则S和N原子个数比为
:
=1:1,其相对分子质量在170~190之间,设化学式为(SN)x,则170<46x<190,解得x=4时,故二者形成的分子式为S4N4,故答案为:S4N4;
(8)ⅦA族元素获得一个电子形成稳定结构,而a元素的原子的获得一个电子即可达到稳定结构,可以放在ⅦA族e元素上方,故答案为:因为a元素的原子的获得一个电子即可达到稳定结构.
(1)b为C,原子核外有2个电子层,各层电子数为2、4,其原子结构示意图为:
 ,故答案为:
,故答案为: ;
;(2)由m在周期表位置可知其位于第四周期第Ⅷ族,第六周期容纳32种元素,故答案为:第四周期第Ⅷ族;32;
(3)给元素形成的化合物分子含有四核18电子为H2O2,故答案为:H2O2;
(4)非金属性Si<S<Cl,非金属性越强,元素最高价含氧酸的酸性越强,故酸性:H2SiO3<H2SO4<HClO4,故答案为:H2SiO3<H2SO4<HClO4;
(5)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:O2->F->Na+>Mg2+,故答案为:O2->F->Na+>Mg2+;
(6)表中某元素的阳离子与含有该元素的某阴离子不能共存,该元素为Al,应是铝离子与偏铝酸根铝离子,二者发生水解反应生成氢氧化铝沉淀,反应离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3 ↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3 ↓;
(7)c为N元素,j为S元素,形成的化合物中N的质量分数为30%,则S和N原子个数比为
| 70% |
| 32 |
| 30% |
| 14 |
(8)ⅦA族元素获得一个电子形成稳定结构,而a元素的原子的获得一个电子即可达到稳定结构,可以放在ⅦA族e元素上方,故答案为:因为a元素的原子的获得一个电子即可达到稳定结构.
点评:本题考查元素周期表与元素周期律、无机物推断、常用化学用语等,难度中等,注意对元素周期律的理解掌握.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
下列实验方法或者实验操作叙述正确的是( )
| A、将pH试纸直接放在某溶液中,测试该溶液的pH |
| B、分液操作时,先将下层液体从下口放出,然后再换个烧杯将上层液体从下口放出 |
| C、过滤操作时,漏斗下端的尖嘴要紧靠烧杯的内壁 |
| D、用乙醇作萃取剂从碘水中提取碘 |
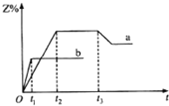 一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )
一密闭容器中加入相同物质的量的X和Y气体,发生反应:X(g)+Y(g)?3Z(g).分别在100℃和300℃反应时Z的体积分数Z%随时间t变化如图所示.已知在t3时改变了某一反应条件.则相关判断正确的是( )| A、曲线b表示的是l00℃时的图象 |
| B、该反应的正反应是吸热反应 |
| C、t2时,曲线a、b对应反应速率v(a)>v(b) |
| D、t3时改变的条件可能是增大了压强 |
下列说法中不正确的是( )
| A、电解MgCl2饱和溶液制取金属镁 |
| B、SO2具有还原性,可使酸性KMn04溶液退色 |
| C、双氧水被称为绿色氧化剂,是因为其还原产物为O2 |
| D、新制备的氯水中存在三种分子、四种离子 |
化学与科学技术、环境和生活密切相关,下列说法 不正确的是( )
| A、新能源具有可再生和无污染等特点,所以应大力提倡采用太阳能、风能和生物质能 |
| B、加高工厂的烟囱,使烟尘和废气远离地表,可减少环境污染 |
| C、可利用分光光度计,通过比色法测定化学反应速率 |
| D、在海伦外壳镶入锌块,可减缓船体的腐蚀速率 |
下列事实能用勒夏特列原理解释的是( )
| A、合成氨工业常采用合适的催化剂 |
| B、配制FeCl2溶液时在溶液中加入少量铁粉 |
| C、NO2与N2O4的平衡体系加压,气体颜色会变深 |
| D、向重铬酸钾溶液中滴加几滴氢氧化钠溶液后,溶液由橙色变为黄色 |
下列说法正确的是( )
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题: A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.
A、D、E、X、Y是原子序数依次增大的短周期主族元素.其中X原子最外层电子数是内层电子总数的3倍;X、Y同族;A与X、Y既不同族也不同周期;D元素的某种同位素原子在考古方面有重要应用.