题目内容
钾是活泼的碱金属,钾和氧气反应时可以生成氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物,现将钾与氧气在一定条件下的反应产物1.1g溶于水,所得溶液用0.5mol/L的HCl溶液进行滴定,终点时消耗HCl溶液40.00mL,则钾与氧气反应产物的成份可能是( )
| A、K2O |
| B、KO2 |
| C、K2O和K2O2 |
| D、K2O和KO2 |
考点:有关混合物反应的计算,化学方程式的有关计算
专题:计算题
分析:根据n=cV计算出40.00mL 0.5mol/L的HCl溶液中氯化氢的物质的量,KOH与HCl的物质的量相等,然后根据钾原子守恒进行讨论钾与氧气反应产物的成份.
解答:
解:1.1g反应产物溶于水后生成溶质为KOH,根据中和反应实质可知:n(KOH)=n(HCl)=0.5mol/L×0.04L=0.02mol,
若完全为氧化钾(K2O),则n(K2O)=
n(KOH)=0.01mol,质量为:m(K2O)=94g/mol×0.01mol=0.94g<1.1g,
若反应产物完全为过氧化钾(K2O2),n(K2O2)=
n(KOH)=0.01mol,质量为:m(K2O2)=110g/mol×0.01mol=1.1g,
若完全为超氧化钾(KO2),n(KO2)=n(KOH)=0.02mol,质量为:m(KO2)=71g/mol×0.02mol=1.42g>1.1g,
根据分析可知,反应产物一定含有氧化钾(K2O)、超氧化钾(KO2),可能含有过氧化钾(K2O2),
故选D.
若完全为氧化钾(K2O),则n(K2O)=
| 1 |
| 2 |
若反应产物完全为过氧化钾(K2O2),n(K2O2)=
| 1 |
| 2 |
若完全为超氧化钾(KO2),n(KO2)=n(KOH)=0.02mol,质量为:m(KO2)=71g/mol×0.02mol=1.42g>1.1g,
根据分析可知,反应产物一定含有氧化钾(K2O)、超氧化钾(KO2),可能含有过氧化钾(K2O2),
故选D.
点评:本题考查了有关讨论的化学计算,题目难度中等,注意掌握有关混合物反应的化学计算方法,明确反应原理为解答关键,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
为检验Na2SO3溶液中是否含有Na2SO4应选用的试剂是( )
| A、BaCl2溶液 |
| B、BaCl2溶液、稀盐酸 |
| C、BaCl2溶液、稀硝酸 |
| D、BaCl2溶液、稀硫酸 |
我们所吃的豆腐是一种( )
| A、糖类 | B、蛋白质 | C、脂肪 | D、淀粉 |
下列关于电解精炼铜的叙述中不正确的是( )
| A、精铜板:阴极 |
| B、电解时,阳极发生氧化反应,而阴极发生的反应为Cu2++2e-→Cu |
| C、粗铜中所含Ni、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥 |
| D、电解铜的纯度可达99.5%~99.98% |
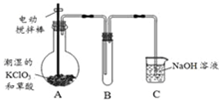 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2. 化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如下关系:
化合物A、D、F是中学化学中最常见的物质,化合物B、C、E中含有两种相同的元素,这些化合物之间存在如下关系: