题目内容
12.下列溶液中的离子一定能大量共存的是( )| A. | 含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 酸性溶液中:Ba2+、NO3-、K+、AlO2- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
分析 A.四种离子之间不发生反应,都不与高锰酸根离子反应;
B.在加入铝粉能产生氢气的溶液中存在大量氢离子或氢氧根离子,亚铁离子、铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下能够氧化亚铁离子;
C.偏铝酸根离子与酸性溶液中的氢离子反应;
D.铁离子与硫氰根离子反应.
解答 解:A.Na+、K+、Cu2+、Fe3+之间不反应,都不与MnO4-反应,在溶液中不能大量共存,故A正确;
B.在加入铝粉能产生氢气的溶液为酸性或强碱性溶液,NH4+、Fe2+能够与碱性溶液中的企业广告离子反应,在酸性条件下发生氧化还原反应,Fe2+、NO3-在溶液中不能大量共存,故B错误;
C.酸性溶液中存在大量氢离子,AlO2-与氢离子反应,在溶液中不能大量共存,故C错误;
D.Fe3+和SCN-之间发生络合反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
2.在0.1mol•L-1 Na2S溶液中,下列关系式正确的是( )
| A. | c(Na+)>c(OH-)>c(HS-)>c(S2-) | B. | c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-) | ||
| C. | 2c(Na+)=c(H2S)+c(HS-)+c(S2-) | D. | c(OH-)=c(H+)+c(HS-)+2c(H2S) |
3. 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
 如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )
如图的装置中,干燥烧瓶中盛有某种气体,烧杯和滴管内盛放某种溶液.挤压滴管的胶头,下列与实验事实不相符的是( )| A. | CO2(NaHCO3溶液) 无色喷泉 | B. | NH3(H2O含酚酞) 红色喷泉 | ||
| C. | NO2(NaOH溶液) 无色喷泉 | D. | HCl (AgNO3溶液) 白色喷泉 |
20.化学在工农业生产和日常生活中都有着重要的应用,下列叙述不正确的是( )
| A. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| B. | 除去溴苯中的溴,可用NaOH溶液洗涤,再分液 | |
| C. | “酸可以除锈”、“热的纯碱溶液去油污”,都发生了化学变化 | |
| D. | 寻找合适催化剂提高合成氨工业中原料的转化率 |
4.在含有稀硫酸的硫酸铁溶液中,下列离子能大量共存的是( )
| A. | HCO3- | B. | NO3- | C. | SCN- | D. | Ba2+ |
1.下表是签别浓硫酸和稀硫酸的方法,请将实验现象填入下表:
| 1 | 浓硫酸 | 稀硫酸 | |
| 物理性质 | 加水 | 放出大量的热 | 现象不明显 |
| 观察态 | 无色粘稠状液体 | 无色液体 | |
| 密度 | 浓硫酸的密度大于稀硫酸 | ||
| 化学性质 | 铁片 | 发生钝化 | 铁片逐渐溶解,并产生无色气体 |
| 铜片(加热) | 刺激性气体 | 无现象 | |
| 白纸 | 变黑 | 无现象 | |
| 胆矾 | 变成白色 | 无现象 | |
12.下表为元素周期表的短周期部分.
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为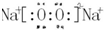 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
| a | |||||||
| b | c | d | |||||
| e | f | g | h |
(1)h原子核外有4 种不同伸展方向的电子云,最外层共有7 种不同运动状态的电子.
(2)比较d、e元素常见离子的半径大小(用化学式表示)O2->Na+;b、c 两元素非金属性较强的是(写元素符号)N,写出证明这一结论的一个化学方程式2HNO3+Na2CO3 =2NaNO3+CO2↑+H2O.
(3)d、e元素形成的四原子化合物的电子式为
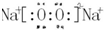 ;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).
;b、g元素形成的分子bg2为非极性分子(填写“极性”或“非极性”).上述元素可组成盐R:ca4f(gd4)2,和盐S:ca4agd4,
(4)相同条件下,0.1mol/L 盐R中c(ca4+)小于(填“等于”、“大于”或“小于”)0.1mol/L 盐S中c(ca4+).
(5)向盛有10mL1mol/L盐S溶液的烧杯中滴加1mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
(6)向盛有10mL 1mol/L盐 R溶液的烧杯中滴加1mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL-35mL)间发生的离子方程式:NH4++OH-=NH3•H2O.若在10mL 1mol/L 盐R溶液的烧杯中加20mL1.2mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.