题目内容
4.在含有稀硫酸的硫酸铁溶液中,下列离子能大量共存的是( )| A. | HCO3- | B. | NO3- | C. | SCN- | D. | Ba2+ |
分析 A.在含有稀硫酸的硫酸铁溶液中,HCO3-和氢离子反应生成二氧化碳和水;
B.NO3-在溶液中不能和其他离子发生反应;
C.SCN-能结合铁离子生成血红色溶液;
D.Ba2+能结合磷酸根离子生成白色沉淀硫酸钡;
解答 解:A.在含有稀硫酸的硫酸铁溶液中,HCO3-和氢离子反应生成二氧化碳和水,HCO3-+H+=CO2↑+H2O,故不能大量共存,故A不符合
B.NO3-在溶液中不能和其他离子发生反应,离子能大量共存,故B符合;
C.SCN-能结合铁离子生成血红色溶液,Fe3++3SCN-=Fe(SCN)3,离子不能大量共存,故C不符合;
D.Ba2+能结合磷酸根离子生成白色沉淀硫酸钡,Ba2++SO42-=BaSO4↓,故D不符合;
故选B.
点评 本题考查了离子性质.离子共存的判断,离子之间的反应实质理解是解题关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.在化学学习中常可根据已知的实验事实,对某些物质的化学性质作出推测,请判断下列推测合理的是( )
| A. | 从红热的铜丝能在氯气中燃烧,推测红热的铁丝也能在氯气中燃烧 | |
| B. | 从碘单质使淀粉试液变蓝,推测 I-也能使淀粉试液变蓝 | |
| C. | 从Fe能从CuSO4溶液中置换出Cu,推测Na也能从CuSO4溶液中置换出Cu | |
| D. | 从二氧化碳通入Ca(OH)2溶液能产生白色沉淀的事实,推测二氧化碳通入CaCl2溶液也能产生白色沉淀 |
12.下列溶液中的离子一定能大量共存的是( )
| A. | 含大量MnO4-的溶液中:Na+、K+、Cu2+、Fe3+ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| C. | 酸性溶液中:Ba2+、NO3-、K+、AlO2- | |
| D. | 含大量Fe3+的溶液中:NH4+、Na+、I-、SCN- |
19.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类.PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害.下列有关叙述不正确的是( )
| A. | PE、PVC都属于高分子化合物 | |
| B. | 质量相同的乙烯和聚乙烯完全燃烧耗氧量相同 | |
| C. | 乙烯和氯乙烯都是不饱和烃,二者都能使溴水褪色,而PE、PVC不能使溴水褪色 | |
| D. | 回收利用废弃的PE和PVC可减少白色污染,焚烧PVC 保鲜膜会放出有毒气体如HCI |
9.下列离子方程式的书写不正确的是( )
| A. | 氧化铁溶于盐酸Fe2O3+6H+═2Fe3++3H2O | |
| B. | Na2CO3溶液滴入盐酸CO32-+H+═HCO3- | |
| C. | NaHCO3溶液和Ca(OH)2溶液等物质的量混合HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| D. | AlCl3溶液滴入氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
16.在1mol•L-1的NaOH溶液100mL中,通入1.68L(STP)SO2气体后,在溶液中存在的溶液是( )
| A. | Na2SO3和NaHSO3 | B. | Na2SO3和NaOH | C. | Na2SO3 | D. | NaHSO3 |
3.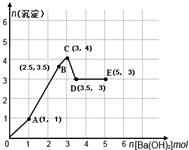 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
 向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )
向物质的量各有1mol的NH4Al(SO4)2和H2SO4混合稀溶液中逐滴加入一定量Ba(OH)2溶液,产生沉淀的量随着Ba(OH)2加入量的变化如图所示.下列离子方程式书写正确的是( )| A. | O→A:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | A→B:2Al3++3SO42-+3Ba2++6OH2-=3BaSO4↓+2Al(OH)3↓ | |
| C. | B→C:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O | |
| D. | D→E:NH4++OH-=NH3•H2O |
4.某有机物分子中有 n 个CH 2,m 个  ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |