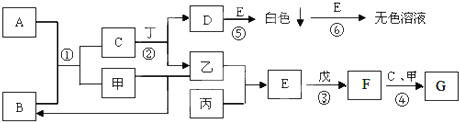
题目内容
8.在一定体积的18mol/L的浓硫酸中加入过量铜片,加热使之反应,产生标况下的SO2的体积为20.16L.则参加反应的浓硫酸的实际体积( )| A. | 大于100mL | B. | 等于100mL | C. | 小于100mL | D. | 无法判断 |
分析 铜只能和浓硫酸反应,而与稀硫酸不反应,由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则二氧化硫的物质的量为:$\frac{20.16L}{22.4L/mol}$=0.9mol,则被还原的硫酸是0.9mol,则18mol•L-1的浓硫酸的实际体积要大于理论计算值,以此来解答.
解答 解:铜只能和浓硫酸反应,而与稀硫酸不反应,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则
由Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O可知,
2 1
1.8mol 0.9mol
理论消耗浓硫酸为$\frac{1.8mol}{18mol/L}$=0.1L=100mL,铜只能和浓硫酸反应,而与稀硫酸不反应,则实际体积大于100mL,
故选A.
点评 本题考查浓硫酸的性质,注意稀硫酸与Cu不反应为解答的关键,把握发生的化学反应及浓度的计算即可解答,题目难度不大.

练习册系列答案
相关题目
18.下列有关物质用途的说法错误的是( )
| A. | 用Na2O2作潜水艇中O2的来源 | B. | 氢氧化铝可作色素的吸附剂 | ||
| C. | 用铝制餐具长时间存放碱性食物 | D. | 明矾可用作净水剂 |
3.下列关于胶体的叙述不正确的是( )
| A. | 胶体和溶液、悬浊液的本质区别是它们分散质粒子的大小 | |
| B. | 光线透过胶体时,胶体发生丁达尔效应 | |
| C. | 布朗运动是胶体粒子特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来 | |
| D. | Fe(OH)3胶体粒子具有较大的表面积,能吸附阳离子,故在电场作用下会定向移动 |
13.从氧化还原反应的角度看,在实验室制取①H2 ②CO2 ③Cl2的三个反应中,盐酸的作用( )
| A. | 互不相同 | B. | 在①和②中相同 | C. | 在②和③中相同 | D. | 在①②③中均相同 |
17.中和相同体积、相同pH的Ba(OH)2、NaOH和NH3H2O三种溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为( )
| A. | V3>V1=V2 | B. | V3=V2>V1 | C. | V3>V2>V1 | D. | V1=V2>V3 |
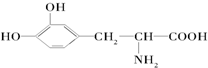 .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )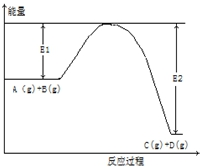 反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.