题目内容
现有反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的正反应为 反应(吸热或放热);且m+n p(填“>”“=”“<”).
(2)减压时,A的质量分数 .(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率 .
(4)若升高温度,则平衡时B、C的浓度之比将 .
(5)若加入催化剂,平衡时气体混合物的总物质的量 .
(6)若B是有色物质,A、C均无色,则加入C(体积不变)后,达到平衡后混合物颜色 ;而维持器内压强不变,充入氖气,最后混合物颜色 (填“变深”“变浅”或“不变”).
(1)该反应的正反应为
(2)减压时,A的质量分数
(3)若加入B(体积不变),则A的转化率
(4)若升高温度,则平衡时B、C的浓度之比将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均无色,则加入C(体积不变)后,达到平衡后混合物颜色
考点:化学平衡的影响因素
专题:
分析:反应:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应吸热,当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和,根据外界条件对化学平衡的影响解答该题.
解答:
解:(1)升高温度时,B的转化率变大,则升高温度平衡正向移动,该反应为吸热反应;减小压强时,混合体系中C的质量分数也减小,则减小压强平衡逆向移动,则m+n>p,故答案为:吸热;>;
(2)减压时,平衡逆向移动,则反应物A的质量分数增大,故答案为:增大;
(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,B加入的多,而转化的少,则B的转化率反而减小,
故答案为:增大;
(4)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的比值将减小,故答案为:减小;
(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变;
(6)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅,
故答案为:变深;变浅.
(2)减压时,平衡逆向移动,则反应物A的质量分数增大,故答案为:增大;
(3)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,B加入的多,而转化的少,则B的转化率反而减小,
故答案为:增大;
(4)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的比值将减小,故答案为:减小;
(5)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变;
(6)若B是有色物质,A、C均无色,则加入C平衡向逆反应方向移动,B的浓度增大,则颜色加深,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,但移动的量远小于体积增大的因素,则B的浓度减小,颜色变浅,
故答案为:变深;变浅.
点评:本题考查外界条件对平衡移动的影响,题目难度不大,注意分析反应的特征为解答该题的关键.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、氯气跟水反应:Cl2+H2O=2H++Cl-+ClO- |
| B、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
| C、碳酸钠溶液中加入少量稀盐酸:CO32-+H+=HCO3- |
| D、铜与稀盐酸反应:Cu+2H+=Cu2++H2↑ |
下列化合物中,属于盐的是( )
| A、H2O |
| B、Na2CO3 |
| C、HNO3 |
| D、KOH |
有两种金属粉末均匀混合组成的混合物2.4g与足量稀盐酸充分反应,生成标准状况下的H22.24L,则该混合物的可能组成为( )
| A、Mg和Al |
| B、Mg和Fe |
| C、Fe和Zn |
| D、Al和Cu |
下列表示物质结构的化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、NaCl的电子式: |
C、镁离子的结构示意图: |
D、CH4的比例模型: |
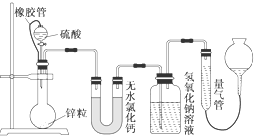 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.