题目内容
下列叙述正确的是( )
| A、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为NA |
| B、标准状况下,22.4 L O2和O3的混合气体所含分子数为NA |
| C、欲配置1.00L,1.00mol?L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 |
| D、2克氢气所含原子数约为6.02×1023 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.缺少氯化镁溶液的体积,无法计算溶液中氯离子的数目;
B.标准状况下,22.4L混合气体的物质的量为1mol;
C.氯化钠溶于1L水中,所得溶液的体积不是1L;
D.2g氢气的物质的量为1mol,1mol氢气含有2mol氢原子.
B.标准状况下,22.4L混合气体的物质的量为1mol;
C.氯化钠溶于1L水中,所得溶液的体积不是1L;
D.2g氢气的物质的量为1mol,1mol氢气含有2mol氢原子.
解答:
解:A.题中没有告诉氯化镁溶液的体积,无法计算溶液中氯离子的物质的量及数目,故A错误;
B.标况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,所含分子数为NA,故B正确;
C.58.5g NaCl的物质的量为1mol,1mol氯化钠溶于1.00L水中,所得溶液的体积不是1L,浓度不是1mol/L,故C错误;
D.2g氢气的物质的量为1mol,1mol氢气中含有氢原子的物质的量为2mol,所含原子数约为2×6.02×1023,故D错误;
故选B.
B.标况下,22.4L氧气和臭氧的混合气体的物质的量为1mol,所含分子数为NA,故B正确;
C.58.5g NaCl的物质的量为1mol,1mol氯化钠溶于1.00L水中,所得溶液的体积不是1L,浓度不是1mol/L,故C错误;
D.2g氢气的物质的量为1mol,1mol氢气中含有氢原子的物质的量为2mol,所含原子数约为2×6.02×1023,故D错误;
故选B.
点评:本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、气体摩尔体积等物理量之间的转化关系,选项A为易错点,注意题中缺少溶液体积.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
下列各组溶液在水溶液中能大量共存,且为无色透明的是( )
| A、K+、SO42-、MnO4-、Cl- |
| B、Na+、NO3-、Ba2+、Cl- |
| C、Cu2+、NO3-、Ba2+、OH- |
| D、K+、SO42-、Fe3+、Cl- |
下列离子方程式正确的是( )
| A、铝与稀硫酸反应:Al+2H+=Al3++H2↑ |
| B、碳酸钙与稀盐酸的反应:CO32-+2H+=CO2+H2O |
| C、氢氧化铁与盐酸的反应:H++OH-=H2O |
| D、三氯化铁腐蚀印刷线路板:2Fe3++Cu=2Fe2++Cu2+ |
标准状况下,VL氯化氢气体溶解在0.2L水中(水的密度近似为1g/mL)所得溶液的密度为ρg/mL质量分数为ω,物质的量浓度为cmol/L,则下列关系中正确的是( )
A、c=
| ||
B、ω=
| ||
C、ω=
| ||
D、c=
|
100mL浓度为2mol/L的盐酸跟过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A、加入适量NaCl溶液 |
| B、加入适量NaOH溶液 |
| C、加入数滴CuCl2溶液 |
| D、加入适量NaNO3溶液 |
下列各组物质不属于同分异构体的是( )
A、 |
B、 |
C、 |
D、 |
在容积固定的密闭容器中,进行反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:下列说法中正确的是( )
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应正反应是吸热反应 |
| B、升高温度,正反应速率加快,逆反应速率减慢 |
| C、该反应达到平衡的标志是压强不再发生改变 |
| D、830℃时平衡常数为1.0,即在此温度下CO2的转化率为50% |
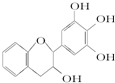 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A、分子中所有的原子共面 |
| B、1 mol EGC与4 mol NaOH恰好完全反应 |
| C、易发生氧化反应和取代反应,能发生加成反应 |
| D、遇FeCl3溶液不发生显色反应 |
短周期元素T、X、Y、Z的原子序数依次增大,T与Z属于同一主族,X、Y、Z最高价氧化物对应的水化物两两之间都能反应,且X、Y、Z原子最外层电子数之和等于X的原子序数.则下列说法正确的是( )
| A、简单离子半径大小顺序:r(T)<r(X)<r(Y) |
| B、T与Z的最高正化合价相等 |
| C、室温下,单质Y不能与浓硫酸反应 |
| D、可用电解法制得X、Y、Z的单质 |