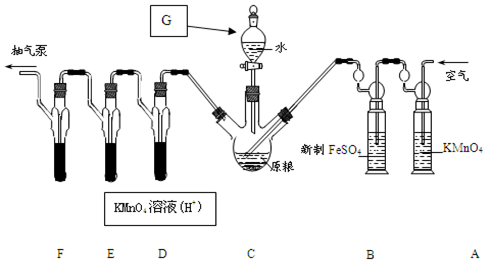
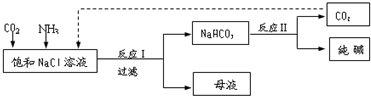
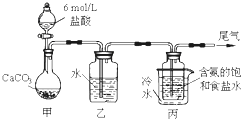
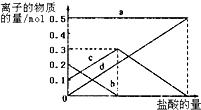
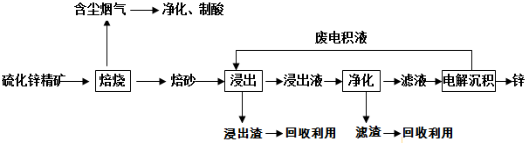
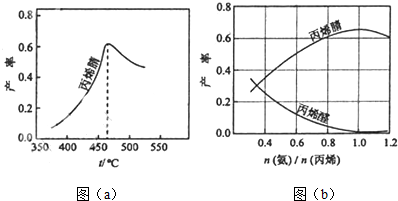
题目内容
2.将Cl2通入到浓氨水中会发生如下反应:3Cl2+8NH3═6NH4Cl+N2,当逸出标准状况下2.24LN2时,反应中有多少克氨被氧化.分析 反应中部分N元素的化合价由-2、3价升高到0价,根据n=$\frac{V}{{V}_{m}}$计算氮气的物质的量,结合反应的化学方程式可计算被氧化的物质的量和质量,以此解答该题.
解答 解:n(N2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,
在3Cl2+8NH3═6NH4Cl+N2中,每生成1molN2,有8molNH3参加反应,其中有2molNH3被氧化,
则 3Cl2+8NH3═6NH4Cl+N2 被氧化NH3
1mol 2mol
0.1mol 0.2mol
则被氧化的氨气为0.2mol,
质量为0.2mol×17g/mol=3.4g,
答:反应中有3.4克氨被氧化.
点评 本题考查氧化还原反应的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握元素化合价的变化,结合方程式计算,难度不大.

练习册系列答案
相关题目
17.下列实验能达到实验目的且符合安全要求的是( )
| A. |  制备氢氧化亚铁并观察其颜色 | B. |  气密性检 | ||
| C. |  制备并检验氢气的可燃性 | D. |  浓硫酸稀释 |
7.一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量为0.8mol.下列判断正确的是( )
| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2min后,加压会使正反应速率增大,逆反应速率减小,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 该条件下此反应的化学平衡常数的数值约为0.91 |
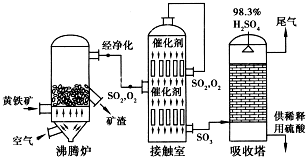
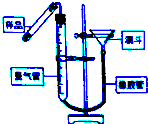 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.