题目内容
3.海水是巨大的资源宝库,海水资源的利用和海水化学资源的利用具有非常广阔的前景.从海水中提取食盐和溴的过程如下:
(1)请列举海水淡化的两种方法:蒸馏法、电渗析法或离子交换法.
(2)步骤Ⅰ中已获得Br2,有关反应的离子方程式为Cl2+2Br-=Br2+2Cl-..
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为SO2+Br2+2H2O═4H++2Br-+SO42-.
(4)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃.微溶于水,有毒性和强腐蚀性.他们参观生产过程后,绘制了如装置简图.

请你参与分析讨论:
①图中仪器B的名称:冷凝管
②实验装置中使用热水浴的原因是加热均匀、容易控制温度
③C中液体产生颜色为深红棕色.为除C中液体中残留的少量Cl2,可向其中加入适量NaBr溶液,充分反应后,再进行分液操作,用这种分离操作方法的不足之处是部分溴单质溶解于水溶液.
分析 通过海水蒸发得到淡水、NaCl、母液,向母液中通入氯气,发生反应Cl2+2Br-=2Cl-+Br2,利用热空气吹出溴,用SO2吸收Br2,发生反应SO2+Br2+2H2O=H2SO4+2HBr,向溶液中通入氯气发生反应Cl2+2Br-=2Cl-+Br2,然后采用萃取的方法获取Br2,
(1)除去海水中的盐分以获得淡水的工艺过程叫海水淡化,亦称海水脱盐.海水淡化的方法,基本上分为两大类:
①从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法;
②除去海水中的盐分,有电渗拆法、离子交换法和压渗法;
(2)步骤Ⅰ中已获得Br2,是氯气氧化溴离子生成溴单质;
(3)SO2吸收溴,依据氧化还原反应生成物书写基本规律,Br元素在自然中-1价稳定.反应有强酸HBr和H2SO4生成;
(4)工业制溴中提纯溴的方法,主要是利用蒸馏方法,由于Br2具有强氧化性,易把橡胶塞和橡胶管氧化腐蚀,所以不用橡胶塞和橡胶管;由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键;C中液体为冷凝下来的纯溴,则颜色为深棕红色,除去该产物中仍残留的少量Cl2,加入NaBr溶液,和氯气反应生成氯化钠和溴单质,达到除去氯气的目的,充分反应后,用蒸馏的方法得到.
解答 解:(1)从海水中取淡水,有蒸留法、反渗透法、水合物法、溶剂萃取法和冰冻法,除去海水中的盐分,有电渗拆法、离子交换法和压渗法,
故答案为:蒸馏法;电渗析法;离子交换法;
(2)步骤Ⅰ中已获得Br2,是氯气氧化溴离子生成溴单质,反应的离子方程式:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
(3)二氧化硫吸收溴单质发生反应,SO2+Br2+2H2O=H2SO4+2HBr,离子方程式为:SO2+Br2+2H2O═4H++2Br-+SO42-,
故答案为:SO2+Br2+2H2O═4H++2Br-+SO42-;
(4)①图中仪器B的名称是冷凝管,故答案为:冷凝管;
②由于题干中给出信息Br2的沸点是59℃,提纯溴必须收集59℃时的馏分,所以控制温度得到馏分是关键,用热水浴加热,加热均匀、容易控制温度,
故答案为:加热均匀、容易控制温度;
③C中液体产物为溴,颜色为深红棕色,为除去该产物中仍残留的少量C12,可向其中加入NaBr溶液,充分反应后,再进行分离的操作是分液,用这种分离操作方法的不足之处是部分溴单质溶解于水溶液,
故答案为:深红棕色;分液.
点评 本题考查了海水资源的综合利用,海水提溴工艺,物质的分离提纯等,注意合成流程中物质的性质及分离方法是解答本题的关键,注重实验操作和分离方法的考查,题目难度中等.

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案| A. | 含两个甲基的醇 C5H12O 被催化氧化后可以得到的羧酸只有一种 | |
| B. | 含两个甲基的氯代烷 C4H8Cl2 消去两分子 HCl 后得到的烃有三种 | |
| C. | 含两个甲基的芳香烃 C9H12有三种 | |
| D. | 含两个甲基的酯 C5H10O2 有四种 |
| A. | 容量瓶 | B. | 试管 | C. | 烧瓶 | D. | 烧杯 |
| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
| A. | 用明矾净水 | B. | 用食醋除去水垢 | ||
| C. | 用石膏使豆浆变成豆腐 | D. | 用含NaHCO3的药物治疗胃酸过多 |
| A. | CH2=CH-CH=CH2 1,3-丁二烯 | B. |  3-丁醇 3-丁醇 | ||
| C. |  甲基苯酚 甲基苯酚 | D. |  2-乙基丙烷 2-乙基丙烷 |
 ;
; ;
; 所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为
所含官能团的名称是碳碳双键,醛基;该有机物发生加聚反应后,所得产物的结构简式为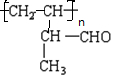 ;
; 工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)+Q(Q>0)
工业上烟气脱氮的原理 NO(g)+NO2(g)+2NH3(g)?2N2(g)+3H2O(g)+Q(Q>0) ;其空间构型为三角锥形;它常用来生产化肥 NH4Cl.NH4Cl 溶液显酸性;
;其空间构型为三角锥形;它常用来生产化肥 NH4Cl.NH4Cl 溶液显酸性;