题目内容
下列离子方程式正确的是( )
| A、用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+C02↑ |
| B、Fe2(SO4)3和Ba(OH)2溶液混合:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
| C、硫酸工业尾气中的SO2用过量的氨水吸收:2NH3?H2O+SO2=2NH4++SO32-+H2O |
| D、Cu溶于浓HNO3:Cu+4H++2NO3一=Cu2++2NO↑+4H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.醋酸在离子反应中保留化学式;
B.不符合离子的配比;
C.反应生成亚硫酸铵和水;
D.反应生成二氧化氮.
B.不符合离子的配比;
C.反应生成亚硫酸铵和水;
D.反应生成二氧化氮.
解答:
解:A.用CH3COOH溶解CaCO3的离子反应为CaCO3+2CH3COOH=Ca2++H2O+C02↑+CH3COO-,故A错误;
B.Fe2(SO4)3和Ba(OH)2溶液混合的离子反应为2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故B错误;
C.硫酸工业尾气中的SO2用过量的氨水吸收的离子反应为2NH3?H2O+SO2=2NH4++SO32-+H2O,故C正确;
D.Cu溶于浓HNO3:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故D错误;
故选C.
B.Fe2(SO4)3和Ba(OH)2溶液混合的离子反应为2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓,故B错误;
C.硫酸工业尾气中的SO2用过量的氨水吸收的离子反应为2NH3?H2O+SO2=2NH4++SO32-+H2O,故C正确;
D.Cu溶于浓HNO3:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故D错误;
故选C.
点评:本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
短周期元素甲、乙、丙、丁的原子序数依次增大,甲是周期表中原子半径最小的元素,乙的单质在暗处与甲的单质剧热反应化合并发生爆炸,甲和丙同主族,丁的最外层电子数和电子层数相等,则( )
| A、原子半径:丙>丁>乙 |
| B、甲与丙的原子核外电子数相差8 |
| C、丙的单质在空气中燃烧生成只含离子键的化合物 |
| D、最高价氧化物对应的水化物的碱性:丙>丁 |
在通常条件下,下列各组物质性质排列正确的是( )
| A、熔点:CO2>KCl>SiO2 |
| B、沸点:HF>HBr>HI |
| C、热稳定性:PH3<H2S<HCl |
| D、硬度:铝>镁>铝镁合金 |
根据有机物的命名原则,下列命名正确的是( )
A、 三甲苯 三甲苯 |
| B、CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
| C、CH3CH(NH2)CH2COOH α-氨基丁酸 |
D、 3,3-二甲基-2-丁醇 3,3-二甲基-2-丁醇 |
据最新科技报道,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是( )
| A、10B和10B20互为同位素 |
| B、10B20是一种高熔点硬度大的物质 |
| C、10B和10B20互为同分异构体 |
| D、10B中子数与核外电子数相同 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1mol羟基的电子数目为10NA |
| B、常温,32g氧气和臭氧的混合物含氧原子素数共2NA |
| C、标准状况下,11.2L的HF所含的分子数为0.5NA |
| D、2mol Na2O2与足量的水反应转移电子数为4NA |
下列化工生产过程不是氧化还原反应的是( )
| A、氮气与氢气合成氨 |
| B、氨气为原料制硝酸 |
| C、磷矿石跟硫酸制磷肥 |
| D、铁矿石炼制生铁 |
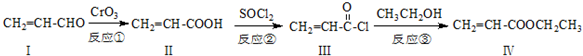
 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:
如图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图: