题目内容
11.将50.5gKNO3溶于水,得到0.5mol/L的溶液,那么所用水的体积是( )| A. | 500mL | B. | 500L | C. | 1L | D. | 无法求解 |
分析 50.5gKNO3的物质的量为:$\frac{50.5g}{101g/mol}$=0.5mol,而根据V=$\frac{n}{c}$=$\frac{0.5mol}{0.5mol/L}$=1L,只能求出溶液的体积,由此分析解答.
解答 解:50.5gKNO3的物质的量为:$\frac{50.5g}{101g/mol}$=0.5mol,而根据V=$\frac{n}{c}$=$\frac{0.5mol}{0.5mol/L}$=1L,只能求出溶液的体积,而不能求出溶剂的体积,要知道水的体积必须溶质的质量分数,
故选D.
点评 本题考查化物质的量浓度的计算,为高考高频考点,侧重于学生的分析能力和计算能力的考查,难度不大.

练习册系列答案
相关题目
2.只表示一种微粒的化学用语是( )
| A. |  | B. | X:X | C. | ns1 | D. | X-X |
6.下列说法中不正确的是( )
| A. | 浓度均为0.1mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) | |
| B. | pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n | |
| C. | 常温下,0.1mol•L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 | |
| D. | 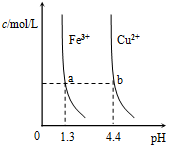 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]<K[Cu(OH)2] |
5. 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
12.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如表:
请回答下列问题:
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 1.716 | 0.5 | 2.758 |
| 2 | 3.432 | 0.5 | |
| 3 | 5.148 | 0.5 | 8.274 |
| 4 | 6.864 | 0.5 | 11.032 |
| 5 | 8.580 | 0.5 | 11.032 |
| 6 | 10.296 | 0.5 | 11.032 |
(1)第二次实验中产生沉淀的质量是5.516g;
(2)求所用Ba(OH)2的溶液的物质的量浓度0.112 g•mol-1;
(3)求混合物中K2CO3和NaHCO3的物质的量之比5:2;
(4)在25℃时,取下第3组实验所得溶液体积的$\frac{1}{10}$,加水配成1000mL溶液,求此溶液pH=12.
10.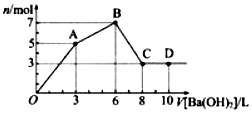 向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
 向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
向含Al2(SO4)3和AlC13的混合溶液中逐滴加入1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )| A. | 图中C点铝元素存在形式是AlO2- | |
| B. | 向D点溶液中通入CO2气体,立即产生白色沉淀 | |
| C. | 原混合溶液中c(Al2(SO4)3):c(AlCl3)=2:l | |
| D. | OA段反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓ |
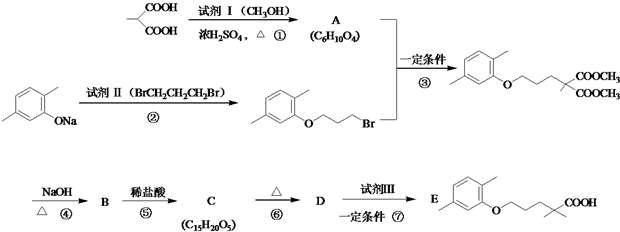
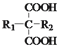 $\stackrel{△}{→}$
$\stackrel{△}{→}$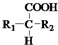 +CO2↑(R1和R2代表烷基)
+CO2↑(R1和R2代表烷基)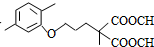 $\stackrel{△}{→}$
$\stackrel{△}{→}$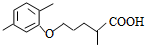 +CO2↑.
+CO2↑.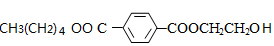 ,则X与Y发生缩聚反应所得缩聚物的结构简式是
,则X与Y发生缩聚反应所得缩聚物的结构简式是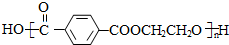 .
.