题目内容
在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:ZnS(s)?Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是( )
| A、加入少量CuS固体 |
| B、加入少量FeS固体 |
| C、加入少量FeCl2固体 |
| D、加入少量CuCl2固体 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:使ZnS减少,应使平衡ZnS(s)?Zn2+(aq)+S2-(aq)向正向移动,从难溶电解质的转化的角度解答该题.
解答:
解:加入少量CuS固体、FeS固体,二者都难溶于水,而加入少量FeCl2固体或CuCl2固体,可满足c(Fe2+)×c(S2-)或c(Cu2+)×c(S2-)大于Ksp,可生成CuS或FeS沉淀,进而促进ZnS的溶解,
故选CD.
故选CD.
点评:本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,注意把握影响平衡移动的因素,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
25℃时,水的离子积为K,该温度下将a mol?L-1盐酸与b mol?L-1氨水等体积混合,若恰好完全反应,下列结论中不正确的是( )
A、混合液中:c(H+)≤
| ||
| B、混合液中:c(NH3H2O)+c(NH4+)=0.5a mol?L-1 | ||
| C、a=b | ||
| D、混合液中,c(H+)+c(NH4+)=c(OH-)+c(Cl-) |
化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq),下列说法正确的是( )
| A、MnS的Ksp比CuS的Ksp小 |
| B、该反应达平衡时c(Mn2+)=c(Cu2+) |
| C、往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
| D、设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) |
关于用CCl4萃取碘水的说法中不正确的是( )
| A、碘在CCl4中的溶解度大于在水中的溶解度 |
| B、萃取后上层颜色变浅 |
| C、萃取后CCl4溶液层为紫红色 |
| D、用酒精也可萃取碘水中的碘 |
对于体积相同的①(NH4)2SO4、②NH4HSO4、③H2SO4溶液,下列说法正确的是( )
| A、溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>① |
| B、溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是① |
| C、溶液的pH相同时,由水电离出的c(H+)大小顺序是③>②>① |
| D、若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③ |


 ③
③ ④
④ ⑤
⑤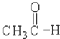 ⑥
⑥