题目内容
某化学兴趣小组在课外实践探究中做了如下实验:将河沙(主要成分是SiO2)与镁粉按一定质量比(质量比约大于15:24)混合均匀,装入试管中加热大约一分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物.
(1)写出河沙的主要成分与镁粉在加热条件下反应的化学方程式: ,该反应 (填“放热”或“吸热”).
(2)生成的混合物放入稀硫酸中,产生的气体是 (填化学式),其电子式为 .
(3)写出产生“爆炸声”的化学方程式: .
(1)写出河沙的主要成分与镁粉在加热条件下反应的化学方程式:
(2)生成的混合物放入稀硫酸中,产生的气体是
(3)写出产生“爆炸声”的化学方程式:
考点:镁的化学性质
专题:元素及其化合物
分析:将河沙(主要成分是SiO2)与镁粉按一定质量比(质量比约大于15:24)混合均匀,装入试管中加热大约一分钟后发生剧烈反应,说明反应是放热反应,生成一种白色固体化合物氧化镁和一种硅化物,待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物硅化氢,所以一种硅化物为硅化镁,由此分析解答.
解答:
解:(1)是二氧化硅与镁发生氧化还原反应,生成氧化镁和硅化镁,所以化学方程式为:SiO2+4Mg
2MgO+Mg2Si,发生剧烈反应可知该反应为放热反应,
故答案为:SiO2+4Mg
2MgO+Mg2Si;放热;
(2)硅化镁和硫酸发生复分解反应生成SiH4;电子式为: ;故答案为:SiH4;
;故答案为:SiH4; ;
;
(3)硅化氢能在空气中自燃,反应方程式为:SiH4+2O2═SiO2+2H2O,故答案为:SiH4+2O2═SiO2+2H2O.
| ||
故答案为:SiO2+4Mg
| ||
(2)硅化镁和硫酸发生复分解反应生成SiH4;电子式为:
 ;故答案为:SiH4;
;故答案为:SiH4; ;
;(3)硅化氢能在空气中自燃,反应方程式为:SiH4+2O2═SiO2+2H2O,故答案为:SiH4+2O2═SiO2+2H2O.
点评:本题考金属镁与二氧化硅反应的相关知识,学生要学会根据化学反应的现象得出结论,来综合分析判断,比较容易.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
某气体物质质量为6.4g,含有6.02×1022个分子,则该气体的相对分子质量为( )
| A、64 | B、32 | C、96 | D、32 |
在3Cl2+6KOH
KClO3+5KCl+3H2O的反应中,下列说法不正确的是( )
| ||
| A、KCl是还原产物,KClO3是氧化产物 |
| B、Cl2是氧化剂,KOH是还原剂 |
| C、反应中每消耗3 mol Cl2,转移电子数为5NA |
| D、被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍 |
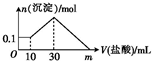 某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )
某一固体物质可能由NaOH、AlCl3、FeCl3、SiO2中的几种组成,将一定量的该固体物质溶于水,有沉淀产生,在所得悬浊液中逐滴加入5mol?L-1的盐酸,如图表示盐酸加入量与沉淀量的变化关系,图中m表示已加入的盐酸体积,则m的数值是( )| A、60 | B、100 |
| C、120 | D、150 |
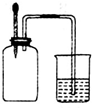 如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )①CO、O2 ②C12、CH4 ③NO2、O2 ④N2、H2.
| A、①② | B、②④ | C、②③ | D、③④ |
下列有关化学反应与能量变化的说法中不正确的是( )
| A、物质发生化学反应的同时都伴随着能量变化 |
| B、伴随能量变化的过程都是化学变化 |
| C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同 |
| D、并不是所有的化学变化都伴随着能量的放出 |
做饭时使用的天然气(主要成分为甲烷)、液化石油气(主要成分为C3H8)燃烧反应的主要化学方程式分别为:CH4+2O2
CO2+2H2O C2H2+5O2
3CO2+4H2O 现有一套以液化石油气为原料的灶具,欲改为烧天然气,应采取的措施是( )
| 点燃 |
| 点燃 |
| A、减小空气进量,增大天然气进量 |
| B、减小空气进量,减小天然气进量 |
| C、增大空气进量,增大天然气进量 |
| D、增大空气进量,减小天然气进量 |
下列物质中,属于共价化合物的是( )
| A、NH4Cl |
| B、HN03 |
| C、NaCl |
| D、I2 |

