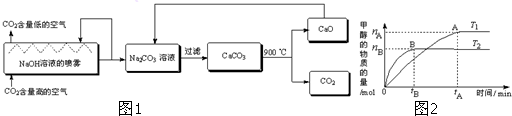
题目内容
工业上用铝土矿(主要成分为Al2O3,Fe2O3等)提取Al2O3做冶炼铝的原料,由熔盐电解法获得的粗铝中含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝.工艺流程如下图所示:

(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)向滤液中通入过量CO2所发生反应的离子方程式为 .
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为 .
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去.气泡的主要成分除Cl2外还含有 .固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在 .
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为 .
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是 .

(已知:NaCl熔点为801℃;AlCl3在181℃升华)
(1)向滤液中通入过量CO2所发生反应的离子方程式为
(2)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,则铝和氧化铁反应的化学方程式为
(3)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去.气泡的主要成分除Cl2外还含有
(4)镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,则阳极的电极反应式为
(5)钢材镀铝后,抗腐蚀性能会大大增强,其原因是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题,元素及其化合物
分析:流程分析可知,铝土矿加入氢氧化钠溶液浸取过滤,滤液中加入过量二氧化碳得到氢氧化铝沉淀,焙烧得到氧化铝,氧化铝电解得到粗铝,粗铝在坩埚中精炼高温通入氯气,将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮而除去,得到高纯铝液,气体冷却得到氯化铝固体,镀铝电解池中,金属铝为阳极,熔融盐电镀液中铝元素主要以AlCl4-形式存在,通过电镀在表面镀铝;
(1)滤液中含有偏铝酸钠,通入过量CO2发生反应生成氢氧化铝沉淀和碳酸氢根离子;
(2)根据氧化铁和石英砂(主要成分是二氧化硅)能分别与铝发生置换反应来书写方程式;
(3)根据题中信息:NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;
(4)电镀池中镀件金属作阳极,金属发生氧化反应;
(5)根据氧化铝的性质来回答.
(1)滤液中含有偏铝酸钠,通入过量CO2发生反应生成氢氧化铝沉淀和碳酸氢根离子;
(2)根据氧化铁和石英砂(主要成分是二氧化硅)能分别与铝发生置换反应来书写方程式;
(3)根据题中信息:NaCl熔点为801℃;AlCl3在181℃升华,在结合物质之间的反应来分析;
(4)电镀池中镀件金属作阳极,金属发生氧化反应;
(5)根据氧化铝的性质来回答.
解答:
解:(1)滤液中含有偏铝酸钠,通入过量CO2所发生反应的离子方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(2)氧化铁和二氧化硅分别与铝发生的是置换反应(单质和化合物发生反应生成新单质和化合物的反应),即铝和氧化铁高温反应生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3
Al2O3+2Fe;
故答案为:2Al+Fe2O3
Al2O3+2Fe;
(3)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为801℃,较高,是固态杂质随气泡上浮,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3;
故答案为:H2、HCl、AlCl3;NaCl;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,Al-3e-+4Cl-=AlCl4-;
故答案为:阳极;Al-3e-+4Cl-=AlCl4-;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生;
故答案为:表面形成的致密氧化铝膜能防止钢材腐蚀或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离.
故答案为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(2)氧化铁和二氧化硅分别与铝发生的是置换反应(单质和化合物发生反应生成新单质和化合物的反应),即铝和氧化铁高温反应生成铁和氧化铝,反应的化学方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
(3)粗铝含有一定量的金属钠和氢气,钠、铝和氯气反应生成了氯化钠和氯化铝,氢气和氯气发生反应生成氯化氢,其中氯化钠熔点为801℃,较高,是固态杂质随气泡上浮,气泡的主要成分除Cl2外还含有H2、HCl、AlCl3;
故答案为:H2、HCl、AlCl3;NaCl;
(4)电镀池中镀件金属铝作阳极,金属铝失电子发生氧化反应,Al-3e-+4Cl-=AlCl4-;
故答案为:阳极;Al-3e-+4Cl-=AlCl4-;
(5)铝金属表面形成的致密氧化铝膜具有保护作用,致密的氧化膜能隔绝钢材与空气中的O2、CO2和H2O等接触,使电化学腐蚀和化学腐蚀不能发生;
故答案为:表面形成的致密氧化铝膜能防止钢材腐蚀或致密的氧化铝膜将环境中的电解质溶液与内层金属隔离.
点评:本题是一道有关金属的工业制备知识题目,考查角度广,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列各组物质的水溶液不用试剂无法鉴别出来的是( )
| A、NaOH、AlCl3 |
| B、CuSO4、BaCl2 |
| C、NaAlO2、HCl |
| D、MgCl2、AlCl3 |
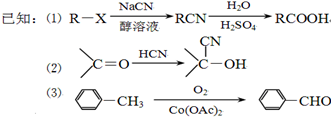
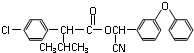 ):
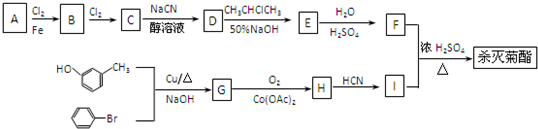
):
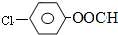 结构,则符合此条件的F共有
结构,则符合此条件的F共有