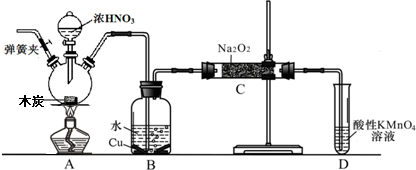
题目内容
19.实验室常用MnO2和浓盐酸反应制取Cl2(1)试写出该反应的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)反应中Cl元素的化合价升高,则该元素的原子失电子.
(3)当反应中转移的电子数目为0.4NA时,生成的Cl2在标准状态下的体积为4.48L.
(4)Cl2用途广泛,写出其生产漂白液对应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
(2)Cl元素的化合价升高,失电子;Mn元素的化合价降低,得电子;
(3)反应MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O转移电子2mol时,生成的氯气物质的量为1mol,当反应中转移的电子数目为0.4NA时,生成氯气的量为0.2mol,体积为:0.2mol×22.4L/mol=4.48L,由此解答;
(4)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,根据离子方程式的书写规则书写.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)Cl元素的化合价升高,失电子;Mn元素的化合价降低,得电子,故答案为:Cl;失;
(3)反应MnO2+4HCl(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O转移电子2mol时,生成的氯气物质的量为1mol,当反应中转移的电子数目为0.4NA时,生成氯气的量为0.2mol,体积为:0.2mol×22.4L/mol=4.48L,故答案为:4.48L;
(4)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂中元素的变化来解答,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 16:9 | B. | 9:11 | C. | 32:9 | D. | 46:9 |
| A. | NO2和N2O4组成的46g混合气体中氮原子的数目为NA | |
| B. | 1molC2H2分子中含有σ键的数目为2NA | |
| C. | HClO光照分解产生22.4LO2,转移的电子数为4NA | |
| D. | 常温下,1L0.1mol/LFe2(SO4)3溶液中阳离子数小于0.2NA |
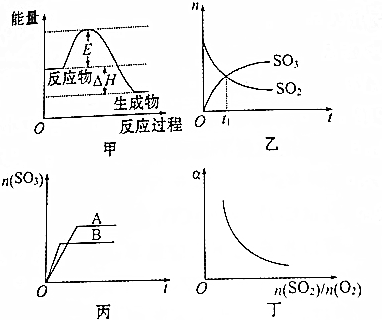
| A. | 加入适当的催化剂后,甲图中的E和△H都减小 | |
| B. | 乙图中t1时刻反应达到化学平衡状态 | |
| C. | 丙图可以表示其他条件不变时,压强对反应的影响 | |
| D. | 丁图中a可以表示SO2的转化率 |
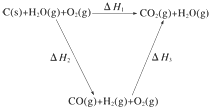 将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g); .K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.
.K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.