题目内容
 某温度下,向一定体积0.1mol?L-1的氨水中逐滴滴加0.1mol?L-1的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是( )
某温度下,向一定体积0.1mol?L-1的氨水中逐滴滴加0.1mol?L-1的盐酸,溶液中pH与pOH[注:pOH=-lgc(OH-)]的变化关系如图所示,则下列说法中错误的是( )| A、M点所示溶液中c(NH4+)>c(Cl-) |
| B、Q点所示溶液的导电能力强于M点 |
| C、Q点消耗盐酸的体积等于氨水的体积 |
| D、M点和N点所示溶液中水的电离程度相同 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:碱溶液中pOH越大、pH越小,说明溶液中氢氧根离子浓度越小,氢离子浓度越大,碱性越弱、酸性越强,随着盐酸的加入,发生中和反应,溶液氢氧根离子的浓度逐渐减小,则溶液pH逐渐减小,pOH逐渐增大,结合弱电解质的电离解答该题.
解答:
解:A.由图象可知M点时pH>pOH,说明c(OH-)>c(H+),溶液呈碱性,由电荷守恒可知c(NH4+)>c(Cl-),故A正确;
B.由于一水合氨为弱碱,电离程度很小,离子浓度也较小,M点溶液的导电能力较小,故B正确;
C.Q点时pH=pOH,说明c(OH-)=c(H+),溶液呈中性,因一水合氨为弱碱,若反应后呈中性,加入盐酸体积应较小,故C错误;
D.由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故D正确.
故选C.
B.由于一水合氨为弱碱,电离程度很小,离子浓度也较小,M点溶液的导电能力较小,故B正确;
C.Q点时pH=pOH,说明c(OH-)=c(H+),溶液呈中性,因一水合氨为弱碱,若反应后呈中性,加入盐酸体积应较小,故C错误;
D.由于M点的OH-浓度等于N点的H+浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,故D正确.
故选C.
点评:本题考查酸碱中和的定性判断和计算,侧重于弱电解质的电离的考查,注意弱电解质的电离特点,把握pOH的含义,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| B、15g甲醛(HCHO)和乙酸的混合物与氧气充分反应,转移的电子数为0.3NA |
| C、一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA |
| D、常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
湖北荆门某化工厂违规快递有毒化学品,因泄漏导致9人中毒,1人死亡.涉事有毒化学品名为氟乙酸甲酯(C3H5O2F),其具有-COO-结构的同分异构体还有(不考虑-O-F结构及立体异构)( )
| A、4种 | B、5种 | C、6种 | D、7种 |
下列实验装置正确且能达到目的是( )


| A、装置①可用于已知浓度的氢氧化钠溶液测定未知浓度盐酸的实验 |
| B、装置②可用于氯化铵固体和氢氧化钙固体反应制取少量氨气 |
| C、装置③可用于收集SO2,并吸收多余的SO2 |
| D、装置④可用于制取少量Cl2 |
利用如图装置,可完成很多电化学实验.下列有关叙述,正确的是( )
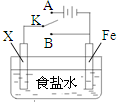

| A、若X为锌棒,开关K置于A处,可减缓铁的腐蚀,这种方法称为牺牲阴极的阳极保护法 | ||||
B、若X为铜棒,开关K置于A处,装置中发生的总反应为2NaCl+2H2O
| ||||
| C、若X为碳棒,开关K置于B处,在铁棒附近滴入硫氰化钾溶液可看到溶液变血红色 | ||||
| D、若X为碳棒,开关K置于B处,向食盐水中滴入酚酞溶液可看到碳棒附近先变红 |
为探究Fe2+对O3氧化I-反应的影响,某研究小组测定两组实验中I3-浓度和体系pH,结果见以下图表.

下列说法不正确的是( )

下列说法不正确的是( )
A、在溶液中存在化学平衡I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为
| ||||
| B、第2组实验进行18s后,由于I2(g)不断生成导致I3-浓度下降 | ||||
| C、3-18s内第2组实验中生成I3-的平均反应速率约为0.55mol/(L?s) | ||||
| D、Fe2+可作为O3氧化I-的催化剂 |

 某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化.(固定装置略去)