题目内容
已知某硫酸和盐酸组成的混合溶液中c(H+)=0.1mol?L-1,将50mL上述混合溶液与50mL Ba(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,此时溶液中OH-的浓度为0.1mol?L-1(设此时溶液体积为100mL).试计算:
(1)原混合液中SO42-、Cl-的物质的量;
(2)混合前Ba(OH)2溶液的物质的量浓度.
(1)原混合液中SO42-、Cl-的物质的量;
(2)混合前Ba(OH)2溶液的物质的量浓度.
考点:有关混合物反应的计算
专题:计算题
分析:(1)0.466g沉淀为硫酸钡,根据n=
计算n(BaSO4),根据SO42-~BaSO4计算n(SO42-),根据n=cV计算n(H+),由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),据此计算n(Cl-);
(2)根据Ba(OH)2~2H+计算参加反应n[Ba(OH)2],根据n=cV计算反应后溶液中n(OH-),进而计算剩余n[Ba(OH)2],再计算氢氧化钡总物质的量,再根据c=
计算.
| m |
| M |
(2)根据Ba(OH)2~2H+计算参加反应n[Ba(OH)2],根据n=cV计算反应后溶液中n(OH-),进而计算剩余n[Ba(OH)2],再计算氢氧化钡总物质的量,再根据c=
| n |
| V |
解答:
解:反应后碱有剩余,酸完全反应,硫酸根完全沉淀,n(BaSO4)=
=0.002mol,则:
SO42-~BaSO4
1 1
n(SO42-) 0.002mol
故n(SO42-)=
=0.002mol
原混合反应中n(H+)=c?V=0.05L×0.1mol/L=0.005mol
由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),n(Cl-)=0.005mol-0.002mol×2=0.001mol,
答:原混合液中SO42-的物质的量为0.002mol、Cl-的物质的量为0.001mol.
(2)原混合反应中n(H+)=c?V=0.05L×0.1mol/L=0.005mol,
令参加反应的氢氧化钡的物质的量为y,则:
Ba(OH)2~2H+
1 2
y 0.005mol
y=0.005mol÷2=0.0025mol
反应后溶液中:n(OH-)=c?V=0.1L×0.1mol/L=0.01moL,故n剩余[Ba(OH)2]=0.01mol÷2=0.005mol,故混合前Ba(OH)2溶液的物质的量:0.005mol+0.0025mol=0.0075mol,故混合前Ba(OH)2溶液的物质的量浓度:C=
=0.15mol/L,
答:混合前Ba(OH)2溶液的物质的量浓度为0.15mol/L.
| 0.466g |
| 233g/mol |
SO42-~BaSO4
1 1
n(SO42-) 0.002mol
故n(SO42-)=
| 0.002mol×1 |
| 1 |
原混合反应中n(H+)=c?V=0.05L×0.1mol/L=0.005mol
由电荷守恒可知n(H+)=2n(SO42-)+n(Cl-),n(Cl-)=0.005mol-0.002mol×2=0.001mol,
答:原混合液中SO42-的物质的量为0.002mol、Cl-的物质的量为0.001mol.
(2)原混合反应中n(H+)=c?V=0.05L×0.1mol/L=0.005mol,
令参加反应的氢氧化钡的物质的量为y,则:
Ba(OH)2~2H+
1 2
y 0.005mol
y=0.005mol÷2=0.0025mol
反应后溶液中:n(OH-)=c?V=0.1L×0.1mol/L=0.01moL,故n剩余[Ba(OH)2]=0.01mol÷2=0.005mol,故混合前Ba(OH)2溶液的物质的量:0.005mol+0.0025mol=0.0075mol,故混合前Ba(OH)2溶液的物质的量浓度:C=
| 0.0075mol |
| 0.05L |
答:混合前Ba(OH)2溶液的物质的量浓度为0.15mol/L.
点评:本题考查混合物计算,难度不大,清楚发生的反应是关键,注意根据方程式计算.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、1mol NH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为2NA |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1L 0.1mol/L NaCl溶液中所含的Na+为NA |
下列各组物质中,所含分子数相同的是( )
| A、5.6L N2(标准状况)和11g CO2 |
| B、10g H2 和10g O2 |
| C、9g H2O 和9mol H2O |
| D、标准状况下22.4L H2O 和22.4L N2 |
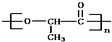 是由一种单体缩聚而成的,该单体的键线式为
是由一种单体缩聚而成的,该单体的键线式为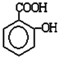 )滴入Na2CO3溶液中发生的化学方程式:
)滴入Na2CO3溶液中发生的化学方程式: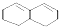 在较高温度下和Br2按物质的量之比1:1发生加成反应的化学方程式
在较高温度下和Br2按物质的量之比1:1发生加成反应的化学方程式