题目内容
20.以下能正确表示电离方程式的是( )| A. | BaSO4(s)?Ba2+(aq)+SO42-(aq) | B. | HClO=H++ClO- | ||
| C. | NaHSO3=Na++H++SO32- | D. | H2S+H2O?H3O++HS- |
分析 化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开.强电解质用等号,弱电解质用可逆号,据此分析.
解答 解:A、BaSO4是强电解质,能完全电离,故电离方程式用等号,故电离方程式为:BaSO4=Ba2++SO42-,故A错误;
B、HClO是弱酸,不能完全电离,故用可逆号,故正确的电离方程式为:HClO?H++ClO-,故B错误;
C、HSO3-是酸式的弱酸根,不能完全电离,故不能拆,即NaHSO3的电离方程式为:NaHSO3=Na++HSO3-,故C错误;
D、H2S是二元弱酸,在溶液中的电离分步进行,故H2S+H2O?H3O++HS-,故D正确.
故选D.
点评 本题难度不大,书写电离方程式时注意离子的正确书写、电荷守恒、离子团不能拆开.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
8.下列反应的离子方程式书写正确的是( )
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 水玻璃中通入过量二氧化碳气体:SiO32-+CO2+H2O═H2SiO3+CO32- | |
| C. | 浓烧碱溶液中加入铝片:Al+OH-+H2O═AlO2-+H2↑ | |
| D. | NaHSO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
15.某溶液中,只含有下表中所示的四种离子(忽略水的电离),则X离子及其物质的量浓度b可能为( )
| 离子 | Mg2+ | Al3+ | Cl- | X |
| 物质的量浓度 | a | 2a | 2a | b |
| A. | Na+、6a | B. | SO42-、3a | C. | OH-、6a | D. | CO32-、4a |
5.常温下,将体积均为10mL,pH均为11的 NaOH和CH3COONa溶液加水稀释,pH变化如图所示,下列结论正确的是( )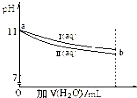

| A. | I 和 II 溶液中,离子种类数相同 | |
| B. | a 点处,I 溶液的浓度为 10-3mol?L-1 | |
| C. | a 点处,I、II 对水的电离平衡影响相同 | |
| D. | b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
9.下列各种冶炼方法中,可制得相应金属的为( )
| A. | 加热氧化钠 | B. | 电解熔融氯化镁 | ||
| C. | 氧化铝与一氧化碳高温反应 | D. | 氯化钠与铝粉高温共热 |
10.将2.8g铁粉加入25mL 2mol•L-1的氯化铁溶液中,充分反应后,设溶液体积不变,关于其结果说法正确的是( )
| A. | 铁粉与氯化铁恰好完全反应,Cl-基本保持不变 | |
| B. | 往溶液中滴入无色KSCN溶液,溶液变红色 | |
| C. | 氧化产物和还原产物的物质的量之比为1:2 | |
| D. | 反应后溶液中Fe2+ 离子的浓度为 4 mol•L-1 |
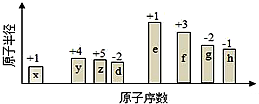 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示.根据判断出的元素回答下列问题: ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)