题目内容
在某无色溶液中,下列各组离子可能大量共存的是( )
| A、Fe3+、NO3-、K+、Na+ |
| B、Cu2+、OH-、SO42-、Cl- |
| C、Ba2+、CO32-、OH-、K+ |
| D、Na+、NH4+、Cl-、NO3- |
考点:离子共存问题
专题:离子反应专题
分析:无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,
A.铁离子为有色离子,不满足溶液无色的要求;
B.铜离子为有色离子,且与氢氧根离子反应生成氢氧化铜沉淀;
C.钡离子与碳酸根离子反应生成难溶物碳酸钡;
D.Na+、NH4+、Cl-、NO3-离子之间不满足离子反应发生条件.
A.铁离子为有色离子,不满足溶液无色的要求;
B.铜离子为有色离子,且与氢氧根离子反应生成氢氧化铜沉淀;
C.钡离子与碳酸根离子反应生成难溶物碳酸钡;
D.Na+、NH4+、Cl-、NO3-离子之间不满足离子反应发生条件.
解答:
解:A.Fe3+为有色离子,不满足溶液无色的条件,故A错误;
B.Cu2+为有色离子,Cu2+、OH-之间发生反应生成难溶物氢氧化铜,在溶液中不能大量共存,故B错误;
C.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故C错误;
D.Na+、NH4+、Cl-、NO3-离子之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
B.Cu2+为有色离子,Cu2+、OH-之间发生反应生成难溶物氢氧化铜,在溶液中不能大量共存,故B错误;
C.Ba2+、CO32-之间反应生成碳酸钡沉淀,在溶液中不能大量共存,故C错误;
D.Na+、NH4+、Cl-、NO3-离子之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评:本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
| A、一定有SO42- |
| B、可能有SO42-或Ag+ |
| C、一定无Ag+ |
| D、还可能有CO32- |
当前我国环保急待解决的“白色污染”通常指的是( )
| A、金属冶炼厂的白色烟尘 |
| B、石灰窑的白色粉尘 |
| C、聚乙烯等塑料垃圾 |
| D、白色建筑废料 |
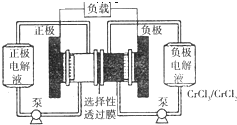 铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ | 放电 |
| 充电 |
| A、电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B、电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C、电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D、电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol?L-1 |
根据下列方程式:①2Fe2++Cl2=2Fe3++2Cl-;②HClO+HCl=Cl2+H2O;③2Fe3++Cu=2Fe2++Cu2+;④Fe+Cu2+=Fe2++Cu,下列各组物质氧化性强弱顺序正确的是( )
| A、Fe3+>HClO>Cl2>Fe2+>Cu2+ |
| B、HClO>Cl2>Fe3+>Cu2+>Fe2+ |
| C、Cl2>HClO>Fe3+>Cu2+>Fe2+ |
| D、HClO>Fe3+>Cl2>Cu2+>Fe2+ |
在溶液导电性实验装置里,分别注入同体积同浓度的H2SO4溶液与Ba(OH)2溶液,灯光明暗程度相似.如果把这两种溶液混合后再实验,则( )
| A、灯光明暗程度不变 |
| B、灯光变暗或不亮 |
| C、灯光变亮 |
| D、无法判断 |
下列事实与胶体性质无关的是( )
| A、在豆浆里加入盐卤做豆腐 |
| B、盐碱地保肥能力差 |
| C、一束平行光线照射蛋白质溶液,从侧面可以看到一束光亮的通路 |
| D、氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
