题目内容
17.用“双线桥法”标明电子转移的方向和数目.MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
有0.5mol氯气生成,则转移的电子的数目是NA、被氧化的盐酸质量36.5g,该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,该反应中浓盐酸表现了还原性和酸性.
分析 MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,Mn元素的化合价降低,Cl的元素的化合价升高,以此来解答.
解答 解:在MnO2+4HCl (浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O的反应中,锰元素化合价降低,氯元素化合价升高,转移电子数为2mol,用“双线桥法”表示氧化还原反应中电子转移情况为: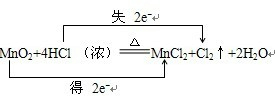 ;有0.5mol氯气生成,则转移的电子的数目是NA;被氧化的HCl为1mol,其质量为36.5g;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;反应中浓盐酸中部分HCl被氧化表现还原性,部分盐酸起酸性作用;
;有0.5mol氯气生成,则转移的电子的数目是NA;被氧化的HCl为1mol,其质量为36.5g;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;反应中浓盐酸中部分HCl被氧化表现还原性,部分盐酸起酸性作用;
故答案为: ;NA;36.5;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;还原、酸.
;NA;36.5;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;还原、酸.
点评 本题考查氧化还原反应,侧重基本概念及转移电子数的考查,明确反应中元素的化合价变化即可解答,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
7.下列关于原子结构的说法正确的是( )
| A. | 原子由原子核和核外电子构成 | |
| B. | 对于任何微粒,质子数等于核外电子数都成立 | |
| C. | 当微粒达到稳定结构时,最外层电子数一定是8 | |
| D. | 原子的质量等于原子核的质量 |
8.下列仪器的选用正确的是( )
| A. | 称量10.56gNa2CO3固体--用托盘天平 | |
| B. | 准确量取10.00mL的溶液--用50mL量筒 | |
| C. | 灼烧干海带至完全变成灰烬--用蒸发皿 | |
| D. | 过滤煮沸后的硬水--用普通漏斗 |
5.对下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、Al2O3、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质.
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、Al2O3、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质.
| A. | ①②③④⑤⑥ | B. | ④⑥ | C. | ②⑤⑥ | D. | ②⑤ |
7.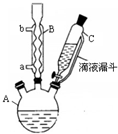 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
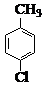 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$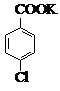 +MnO2
+MnO2
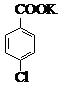
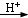
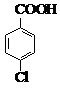
常温条件下的有关数据如下表所示:
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g.
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图: $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$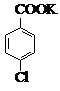 +MnO2
+MnO2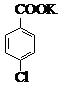
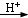
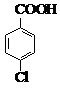
常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%
4.为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
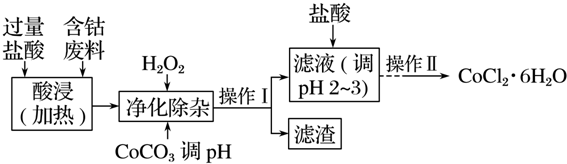
5.CoCl2•6H2O常用作多彩水泥的添加剂,以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:
已知:
(1)净化除杂质时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
(2)加入CoCO3调pH为5.2~7.6,则操作Ⅰ获得的滤渣成分为Fe(OH)3、Al(OH)3.
(3)加盐酸调整pH为2~3的目的为抑制CoCl2水解.
(4)操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤、洗涤、干燥.其中洗涤的操作为在过滤器中加入蒸馏水使水没过晶体,静置,使其自然流下,重复2-3次.