题目内容
12.(1)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍.则X的相对原子质量为34-m.(用含m的代数式表示)(2)某常见气体在标准状况下的密度为1.25g/L请填空:
该气体的摩尔质量为28g.mol-1.若气体的化学式为AB型,其名称为一氧化碳_.
(3)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为62g/mol,X的相对原子质量为16,该物质的化学式为Na2O.
(4)相同质量的两种气体CO2和N2,它们的物质的量比是7:11,它们所含分子数比是7:11,在相同条件下它们的体积比是7:11.则它们的密度之比为11:7,摩尔质量之比为11:7.
(5)在标准状况下a.6.72L CH4气体 b.3.01×1023个HCl气体分子 c.13.6g H2S气体 d.0.2molNH3,下列对这四种气体的关系从大到小的排列是(用上述序号表示)
①四种气体所含有的分子数bcad,②四种气体所含有的原子数acbd.
分析 (1)同温同压下,密度之比等于相对分子质量之比,据此计算H2X的相对分子质量,进而计算X的相对原子质量;
(2)该气体在标准状况下的密度为1.25g•L-1,M=ρVm,则A的相对分子质量为28,根据常见气体分析;
(3)12.4克Na2X中含有0.4molNa+,根据Na2X的组成计算出Na2X的物质的量及摩尔质量,根据摩尔质量与相对分子量的关系计算出X的相对原子质量,根据Na2X相对原子质量来确定分子式;
(4)令CO2和N2的质量都是1g,根据n=$\frac{m}{M}$计算各自物质的量,分子数目之比等于其物质的量之比;在相同条件下,气体体积之比等于物质的量之比;
相同条件下,密度之比等于其相对分子质量之比;摩尔质量之比等于其相对分子质量之比;
(5)依据n=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$=$\frac{m}{M}$计算解答.
解答 解:(1)相同状况下,一定体积的气态氢化物HmX的质量是等体积NH3的2倍,则二者密度之比为2:1,同温同压下,密度之比等于相对分子质量之比,HmX的相对分子质量为17×2=34,则X的相对原子质量为34-m,
故答案为:34-m;
(2)该气体在标准状况下的密度为1.25g•L-1,M=ρVm=1.25g•L-1×22.4L/mol=28g/mol,则A的相对分子质量为28,若该气体的化学式为AB型,则为一氧化碳;
故答案为:28 g.mol-1,一氧化碳;
(3)12.4克Na2X中含有0.4molNa+,Na2X的物质的量为:n(Na2X)=$\frac{1}{2}$n(Na+)=0.4mol×$\frac{1}{2}$=0.2mol,
Na2X的摩尔质量为:M(Na2X)=$\frac{12.4g}{0.2mol}$=62g/mol;
钠原子的相对原子质量是23,所以X的相对原子质量是62-23×2=16;
X为氧原子,该物质的化学式为Na2O,
故答案为:62g/mol;16;Na2O.
(4)令CO2和N2的质量都是1g,NO的物质的量=$\frac{1g}{28g/mol}$=$\frac{1}{28}$mol,CO2的物质的量=$\frac{1g}{44g/mol}$=$\frac{1}{44}$mol,
CO2和N2物质量之比为:$\frac{1}{44}$mol:$\frac{1}{28}$mol=7:11;
CO和CO2分子数目之比:$\frac{1}{44}$mol:$\frac{1}{28}$mol=7:11;
在相同条件下,气体体积之比等于物质的量之比:7:11;
相同条件下,密度之比等于其相对分子质量之比等于:11:7;
摩尔质量之比等于其相对分子质量之比:11:7;
故答案为:7:11,7:11,7:11,11:7,11:7;
(5)a.6.72L CH4气体,其物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,含有原子物质的量为0.3mol×5=1.5mol;
b.3.01×1023个HCl气体分子,其物质的量为$\frac{3.01×10{\;}^{23}}{6.02×1{0}^{23}}$=0.5mol,含有原子物质的量为0.5mol×2=1mol;
c.13.6g H2S气体,其物质的量为$\frac{13.6g}{34g/mol}$=0.4mol,含有原子物质的量为0.4mol×3=1.2mol;
d.0.2mol NH3,含有原子的物质的量为0.2mol×4=0.8mol;
所以四种气体所含有的分子数,从大到小的排列是:bcad;
摩尔质量之比等于其相对分子质量之比:acbd;
故答案为:bcad;acbd.
点评 本题考查物质的量的计算,为高频考点,把握以物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.

| A. | 把SiO2加入到NaOH溶液中:SiO2+2OH-═SiO32-+H2O | |
| B. | 向NaHCO3溶液中滴入NaOH溶液:HCO3-+OH-═CO2↑+H2O | |
| C. | 向Al(OH)3中滴入H2SO4溶液:Al(OH)3+3H+═Al3++3H2O | |
| D. | 向Na2CO3溶液中滴入AgNO3溶液:2Ag++CO32-═Ag2CO3↓ |
| A. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+ | |
| C. | NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- | |
| D. | 石灰石溶于醋酸:CaCO3+2CH3COOH═2CH3COO-+Ca2++CO2↑+H2O |
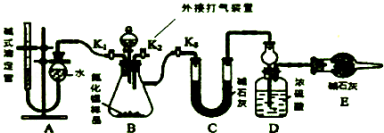
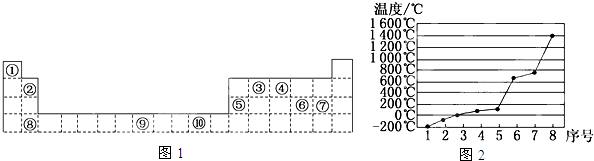
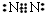 ;
;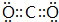
 ,用电子式表示化合物 C2D 的形成过程
,用电子式表示化合物 C2D 的形成过程 .
.