题目内容
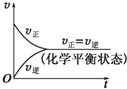
如图②为恒压容器,①③④为恒容容器,起始加入物如下,且起始容积均相等,维持恒温的条件下发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-197KJ/mol达平衡后,各容器内放出热量Q1、Q2、Q3和Q4的大小关系正确的是( )


| A、197>Q1>Q2 |
| B、Q1>2Q3 |
| C、Q1=Q4 |
| D、Q3<Q4 |
考点:化学平衡建立的过程,等效平衡
专题:化学平衡专题
分析:A、容器②相当于①容器达到平衡状态后再加压,看平衡向右移动;
B、当③容器为①容器容积一半大小时,两容器可建立等效平衡,在此基础上再改变;
C、①和④两容器的平衡状态是等效平衡,但起始状态不同;
D、④相当于在③达到平衡后,再加入1molSO3,平衡逆向移动.
B、当③容器为①容器容积一半大小时,两容器可建立等效平衡,在此基础上再改变;
C、①和④两容器的平衡状态是等效平衡,但起始状态不同;
D、④相当于在③达到平衡后,再加入1molSO3,平衡逆向移动.
解答:
解:A、容器②相当于①容器达到平衡状态后再加压,而加压时平衡向右移动,反应物转化率增大,放出的热量更多,即Q2>Q1,故A错误;
B、当③容器为①容器容积一半大小时,两容器可建立等效平衡,此时①放热等于③放热的2倍,再将③容积扩大2倍以满足题中条件时,平衡逆向移动,反应物转化率降低,放热减少,即Q1>2Q3,故B正确;
C、①和④两容器的平衡状态是等效平衡,但起始状态不同,所以放热不相等,故C错误;
D、④相当于在③达到平衡后,再加入1molSO3,而增大SO3的浓度平衡逆向移动,放热必然减少,即Q3>Q4,故D错误.
故选B.
B、当③容器为①容器容积一半大小时,两容器可建立等效平衡,此时①放热等于③放热的2倍,再将③容积扩大2倍以满足题中条件时,平衡逆向移动,反应物转化率降低,放热减少,即Q1>2Q3,故B正确;
C、①和④两容器的平衡状态是等效平衡,但起始状态不同,所以放热不相等,故C错误;
D、④相当于在③达到平衡后,再加入1molSO3,而增大SO3的浓度平衡逆向移动,放热必然减少,即Q3>Q4,故D错误.
故选B.
点评:本题考查学生对化学平衡的有关计算,影响化学平衡的因素,达到化学平衡的标志,化学平衡常数等考点的理解.

练习册系列答案
相关题目
下列物质的鉴别方法错误的是( )
| A、用酚酞溶液鉴别稀盐酸和稀氢氧化钠溶液 |
| B、用燃着的木条鉴别CO2和O2 |
| C、用稀硫酸鉴别锌片和铜片 |
| D、用加水溶解的方法即可鉴别食盐和白糖 |
在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( )
| A、HCl |
| B、MgSO4 |
| C、CuSO4 |
| D、NaCl |
钓鱼岛及其附属岛屿是中国的固有领土,我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法不正确的是( )
| A、从海带中提取碘单质的过程不涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度很低 |
用如图所示实验装置进行相应实验,能达到实验目的是( )


| A、装置①可用于除去Cl2中含有的少量HCl气体 |
| B、按装置②所示的气流方向可用于收集H2、NH3等 |
| C、装置③可证明非金属性Cl>C>Si |
| D、装置④向左推动针筒活塞可检验该装置的气密性 |
 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A、可与溴水反应,且1mol该物质与足量溴水反应消耗6molBr2 |
| B、可与NaOH溶液反应,1mol该物质可与5molNaOH反应 |
| C、一定条件下1mol该物质可与H2加成,耗H2最大量为6mol |
| D、维生素P能发生水解反应 |