题目内容
19.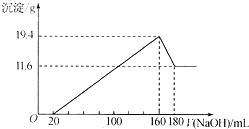 将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:
将一定质量的Mg-Al合金投入到100mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5mol/LNaOH溶液至过量,生成沉淀质量与加入NaOH溶液的体积关系如图所示. 求:(1)写出20ml-160ml阶段的离子反应方程式Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;
(2)160ml-180ml阶段的离子反应方程式Al(OH)3+OH-=AlO2-+2H2O;
(3)原合金分别与足量的稀硫酸和氢氧化钠溶液反应产生气体的在同温同压下的体积比为7:3
(4)HCl的物质的量浓度为8mol/L.
分析 (1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,继续滴加NaOH溶液,NaOH与氯化镁、氯化铝反应生成沉淀;
(2)160ml-180ml阶段,随着氢氧化钠的增加,沉淀减少,NaOH与氢氧化铝反应生成偏铝酸钠和水,;
(3)滴加NaOH溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,则Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3],n(Mg)=n[Mg(OH)2],结合离子方程式计算;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O,继续滴加NaOH溶液,NaOH与氯化镁、氯化铝反应生成沉淀,其反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;Al3++3OH-=Al(OH)3↓;
(2)160ml-180ml阶段,随着氢氧化钠的增加,沉淀减少,NaOH与氢氧化铝反应生成偏铝酸钠和水,其反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)滴加NaOH溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者质量之和为19.4g,溶液为氯化钠溶液.再继续滴加NaOH溶液,到沉淀量开始进行,到沉淀量最小时,沉淀为Mg(OH)2,质量为11.6g,则Al(OH)3的质量为19.4g-11.6g=7.8g,由元素守恒可知,n(Al)=n[Al(OH)3]=$\frac{7.8g}{78g/mol}$=0.1mol,n(Mg)=n[Mg(OH)2]=$\frac{11.6g}{58g/mol}$=0.2mol,原合金与足量的稀硫酸反应离子方程式为:Mg+2H+=Mg2++H2↑、2Al+6H+=2Al3++3H2↑,所以生成氢气为0.2mol+0.15mol=0.35mol,原合金与足量的NaOH溶液反应2Al+2OH-+2H2O=2AlO2-+3H2↑,则生成的氢气为0.15mol,
所以产生气体在同温同压下的体积比为0.35mol:0.15mol=7:3;
故答案为:7:3;
(4)160mL时,溶液中的溶质为NaCl,根据原子守恒得n(NaCl)=n(HCl)=n(NaOH)=0.16L×5mol/L=0.8mol,c(HCl)=$\frac{0.8mol}{0.1L}$=8mol/L,
故答案为:8.
点评 本题考查镁铝化合物性质、混合物的计算,侧重考查分析计算能力,明确各个顶点溶液中物质成分及发生的反应是解本题关键,结合原子守恒解答,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | NH4Cl | B. | MgO | C. | Fe2(SO4)3 | D. | NaHCO3 |
| A. | 负极反应式为Mg-2e-=Mg2+ | |
| B. | 正极反应式为Ag++e-=Ag | |
| C. | 电池放电时Cl-由正极向负极迁移 | |
| D. | 负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑ | |
| E. | 能被KCl溶液激活 | |
| F. | 可用于海上应急照明供电 |
| A. | 用滤纸称量NaOH固体 | B. | 移液前容量瓶内有水珠 | ||
| C. | 摇匀后,液面低于刻度线 | D. | 定容时,俯视刻度线 |
(1)写出碱性中Br2氧化Na2SO3的离子方程式:SO32-+Br2+2OH-=H2O+SO42-+2Br-
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减).
限选试剂:2mol•L-1HCl; l mol•L-1H2SO4; l mol•L-1BaCl2; l mol•L-1Ba(NO3)2; 0.l mol•L-1AgNO3; CCl4; 新制饱和氯水.
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中, 加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液 | 有白色沉淀生成, 证明待测液中含SO42-. |
| 步骤② | 另取少量待测液于试管中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 | 下层出现红棕色,则证明 待测液中含有:Br- |
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式不同 | |
| C. | 通过化学变化可以实现16O2与18O2间的相互转化 | |
| D. | 标准状况下,1.12L16O2和1.12L18O2均含0.1NA个氧原子 |
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子. ;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑.
;Z2Y2与水反应放出气体的离子方程式为Na2O2+2H2O=4Na++4OH-+O2↑. ;
; ,
,

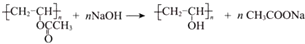 .
. ”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是
”改为“乙醛”,经过②、③、④后得到以顺式结构为主的高聚物,则用结构简式表示其顺式结构是 .
. 为原料合成
为原料合成  ,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式.
,下列是合成流程图,在括号内注明反应条件,方框内写出有关物质的结构简式.