题目内容
下列溶液中微粒浓度关系一定正确的是( )
| A、pH=4的盐酸与pH=10的氨水溶液等体积混合后pH<7 |
| B、25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C、pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D、均为0.10mol?L-1 NH4Cl和NH4HSO4溶液,铵根离子浓度前者小于后者 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.pH=4的盐酸与pH=10的氨水,氨水浓度大,等体积混合,氨水过量;
B.水的电离为吸热反应,升高温度,促进电离;
C.NaOH为强碱,一水合氨为弱碱,稀释100倍,强碱变化大;
D.NH4Cl和NH4HSO4溶液,均存在铵根离子水解,但NH4HSO4溶液中氢离子抑制铵根离子水解.
B.水的电离为吸热反应,升高温度,促进电离;
C.NaOH为强碱,一水合氨为弱碱,稀释100倍,强碱变化大;
D.NH4Cl和NH4HSO4溶液,均存在铵根离子水解,但NH4HSO4溶液中氢离子抑制铵根离子水解.
解答:
解:A.pH=4的盐酸与pH=10的氨水,氨水浓度大,等体积混合,氨水过量,所以混合后溶液的pH>7,故A错误;
B.水的电离为吸热反应,升高温度,促进电离,所以25℃时NH4Cl溶液的KW小于100℃时NH4Cl溶液的KW,故B错误;
C.NaOH为强碱,一水合氨为弱碱,pH=11的NaOH和pH=11的氨水分别稀释100倍后,NaOH的pH=9,而氨水的pH>9,则pH前者一定小于后者,故C错误;
D.NH4Cl和NH4HSO4溶液,均存在铵根离子水解,但NH4HSO4溶液中氢离子抑制铵根离子水解,则均为0.10mol?L-1 NH4Cl和NH4HSO4溶液,铵根离子浓度前者小于后者,故D正确;
故选D.
B.水的电离为吸热反应,升高温度,促进电离,所以25℃时NH4Cl溶液的KW小于100℃时NH4Cl溶液的KW,故B错误;
C.NaOH为强碱,一水合氨为弱碱,pH=11的NaOH和pH=11的氨水分别稀释100倍后,NaOH的pH=9,而氨水的pH>9,则pH前者一定小于后者,故C错误;
D.NH4Cl和NH4HSO4溶液,均存在铵根离子水解,但NH4HSO4溶液中氢离子抑制铵根离子水解,则均为0.10mol?L-1 NH4Cl和NH4HSO4溶液,铵根离子浓度前者小于后者,故D正确;
故选D.
点评:本题考查酸碱混合溶液的定性分析及pH的计算,为高频考点,把握弱电解质的电离、稀释及酸碱混合后溶液中的溶质、盐类水解等为解答的关键,综合性较强,注重基础知识的考查,选项B为解答的易错点,注意Kw只与温度有关.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、Ba(OH)2溶液中滴入CuSO4溶液:2OH-+Cu2+=Cu(OH)2↓ |
| B、澄清石灰水与少量苏打溶液混合:Ca2++CO32-=CaCO3↓ |
| C、碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、Cu与浓硫酸反应:Cu+4H++SO42-=Cu2++SO2↑+2H2O |
下列各组离子中在碱性溶液中能大量共存的是( )
| A、K+、Al3+、Cl-、SO42- |
| B、Na+、AlO2-、NO3-、CO32- |
| C、NH4+、Mg2+、NO3-、SO42- |
| D、Na+、H+、SO42-、Cl- |
下列离子方程式中,正确的是( )
| A、澄清石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O |
| B、钠与水反应 Na+2H2O═Na++2OH-+H2↑ |
| C、Cl2与水反应 Cl2+H2O═Cl-+ClO-+2H+ |
| D、F2与NaOH溶液反应 2F2+4OH-═4F-+O2+2H2O |
在pH=1且含有大量Fe2+和NH4+的溶液中,能大量存在的阴离子是( )
| A、SO42- |
| B、NO3- |
| C、OH- |
| D、HCO3- |
下列关于各装置图的叙述中,不正确的是( )
A、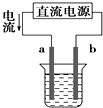 如图装置中a为阳极、b为阴极 |
B、 如图装置的总反应是:Cu+2Fe3+=Cu2++2Fe2+ |
C、 如图装置中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
D、 如图装置中的铁钉几乎不被腐蚀 |
短周期元素X、Y、Z、W、R的原子序数依次增大,元素的最高正价与最低负价如下:
下列说法不正确的是( )
| X | Y | Z | W | R |
| +4-4 | -2 | +1 | +3 | +7-1 |
| A、原子半径:Z>X>Y |
| B、R的含氧酸的酸性一定强于X的含氧酸的酸性 |
| C、X和Y可形成多种共价化合物 |
| D、工业上用电解W的氧化物的方法制备单质W |
 把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:
把18.0mol/L 的浓硫酸稀释成1.80mol/L 的稀硫酸100mL,实验操作如下:
